微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列反应中,属于氧化还原反应的是
[? ]
A.2H2O2 2H2O + O2↑
2H2O + O2↑
B.2Al(OH)3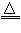 Al2O3 + 3H2O
Al2O3 + 3H2O
C.FeO + 2HCl = FeCl2 + H2O
D.FeCl2 + 2NaOH = Fe (OH)2↓+ 2NaCl
参考答案:A
本题解析:
试题分析:
选项A,反应中H和O元素的化合价变化,是氧化还原反应;
选项B,反应前后元素的化合价不变,不是氧化还原反应;
选项C,反应前后元素的化合价不变,不是氧化还原反应;
选项D,反应前后元素的化合价不变,不是氧化还原反应。
故选:A
本题难度:简单
2、填空题 (8分)二氧化硒(Se)是一种氧剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。
完成下列填空:
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1,写出Se和浓HNO3的反应方式?。
(2)已知:Se+2H2SO4(浓)→2SO2↑+SeO2+2H2O
2SO2+SeO2+2H2O→Se+2SO42-+4H+
SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是? ?。
(3)回收得到的SeO2的含量,可以通过下面的方法测定:
①SeO2+KI+HNO3 Se+I2+KNO3+H2O
Se+I2+KNO3+H2O
②I2+2Na2S2O3 Na2S4O6+2NaI
Na2S4O6+2NaI
配平方程式①,标出电子转移的方向和数目。
(4)实验中,准确称量SeO2样品0.1500g,消耗0.2000 mol·L-1的Na2S2O3溶液25.00 mL,所测定的样品中SeO2的质量分数为?。
参考答案:
 (1)? Se+2HNO3(浓)=H2SeO3+NO↑+NO2↑。
(1)? Se+2HNO3(浓)=H2SeO3+NO↑+NO2↑。
(2)? H2SO4(浓)> SeO2> SO2。
(3)
(4)? 92.5%
本题解析:考查氧化还原反应的有关判断和计算等。
(1)根据已知反应物和生成物并根据电子得失守恒和质量守恒定律可知,反应的化学方程式是Se+2HNO3(浓)=H2SeO3+NO↑+NO2↑。
(2)在氧化还原反应氧化剂的氧化性大于氧化产物的,所以根据反应的化学方程式可知,SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是H2SO4(浓)> SeO2> SO2。
(3)在反应①中Se元素的化合价从+4价降低到0价,而碘元素的化合价从-1价升高到0价,所以根据电子的得失守恒,配平后的方程式是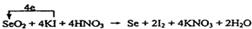 。
。
(4)根据反应①②及电子的得失守恒可知,SeO2~4Na2S2O3,所以参加反应的SeO2的物质的量是0.2000 mol·L-1×0.025L/4=0.00125mol,因此所测定的样品中SeO2的质量分数为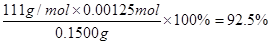 。
。
本题难度:一般
3、选择题 下列四种基本反应中一定属于氧化还原的是
[? ]
A、复分解反应
B、分解反应
C、化合反应
D、置换反应
参考答案:D
本题解析:
本题难度:简单
4、选择题 FeS与足量的稀硝酸反应,生成Fe(NO3)3、S、NO和H2O。若反应中有0.3 mol的电子转移,则参加反应的硝酸中未被还原的硝酸的物质的量为(?)
A.0.9 mol
B.0.45 mol
C.0.3 mol
D.0.1 mol
参考答案:C
本题解析:根据反应前后的化合价的变化可知,FeS是还原剂,每消耗1molFeS反应中就转移3mol电子。所以消耗FeS是0.1mol,则必然生成0.1mol硝酸铁,即未被还原的硝酸是0.3mol,所以答案选C。
本题难度:简单
5、选择题 氧化还原反应是一类重要的化学反应,广泛存在于自然界中,对人们的生产、生活有着十分重要的作用。你认为下列对氧化还原反应的描述不正确的是?
[? ]
A.肯定有电子转移
B.肯定是有关氧元素的反应
C.肯定有元素化合价的变化
D.氧化剂得到电子的总数与还原剂失去电子的总数相等
参考答案:B
本题解析:
本题难度:简单