|
高中化学知识点大全《原电池原理》考点强化练习(2017年押题版)(二)
2017-08-06 09:29:37
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下图为番茄电池,下列说法正确的是

[? ]
A.一段时间后,锌片质量会变小
B.铜电极附近会出现蓝色
C.电子由铜通过导线流向锌
D.铜是该电池的负极
参考答案:A
本题解析:
本题难度:一般
2、选择题 铜、锌和硫酸构成的原电池中,当导线中有1 mol电子通过时,理论上两极的变化是( )
①锌片溶解32.5 g ②锌片增重32.5 g ③铜片上析出1 g H2 ④铜片上析出1 mol H2
A.①③
B.①④
C.②③
D.②④
|
参考答案:A
本题解析:铜、锌和硫酸构成的原电池中,该原电池放电时,电池反应式为Zn+H2SO4=ZnSO4+H2 ↑。设当导线中有1mol电子通过时,理论上负极锌片溶解32.5g ,铜片上析出氢气1g ,选A。
考点:考查原电池的有关计算。
本题难度:一般
3、选择题 观察下列几个装置示意图,有关叙述错误的是(?)
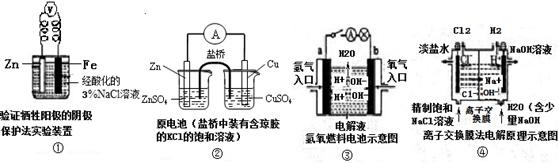
A.装置①中烧杯内中加入黄色的K3[Fe(CN)6]溶液,一段时间后看不到Fe电极附近有蓝色沉淀生成,该装置可看作金属的析氢腐蚀
B.装置②盐桥中的Cl—向硫酸铜溶液移动
C.装置③中外电路电流方向:b极 →a极
D.装置④中阳极反应:2 Cl——2e- = Cl2 ↑
参考答案:B
本题解析:A、装置①是原电池装置,锌作负极,铁作正极,亚铁离子遇到K3[Fe(CN)6]溶液有蓝色沉淀生成,看不到现象说明铁没有被氧化,电解质溶液显酸性,因此发生析氢腐蚀,正确;B、装置②是双液电池,锌作负极,铜作正极,盐桥中阴离子移向负极,向左移,错误;C、装置③是燃料电池,氢气作负极,氧气作正极,电流从正极流向负极,正确;D、装置④是电解池,阳极阴离子失电子发生氧化反应,正确。
本题难度:一般
4、填空题 氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为电池示意图,该电池电
极表面镀一层细小的铂粉,吸附气体的能力强,性质稳定,请回答:
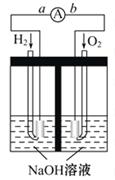
(1) 氢氧燃料电池的能量转化形式主要是____ __,
(2) 在导线中电子流动方向为 ____ → __(用a、b表示)。
(3) 负极反应式为__________ ________。
(4) 电极表面镀铂粉的原因为_____ ____。
参考答案:(1)由化学能转化为电能 (2)由a到b
(3)2H2 + 4OH--4e- = 4H2O 或 H2+2OH--2e- = 2H2O
(4)增大电极单位面积吸附H2、O2分子数,加快电极反应速率
本题解析:(1)根据原电池的工作原理可知,氢氧燃料电池的能量转化形式主要是由化学能转化为电能。
(2)原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应,所以氢气在负极通入,失去电子。氧气在正极通入,得到电子,则在导线中电子流动方向为由a到b。
(3)负极氢气失去电子,且电解质溶液显碱性,则负极电极反应式为H2+2OH--2e- = 2H2O。
(4)电极表面镀铂粉后增大电极单位面积吸附H2、O2分子数,加快电极反应速率。
考点:考查原电池应用的有关判断以及外界条件对反应速率的影响
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,侧重对学生能力的培养和解题方法的指导与训练,有助于培养学生的逻辑推理能力和规范的答题能力。该题的关键是明确原电池的工作原理,然后结合题意灵活运用即可。
本题难度:简单
5、填空题 请按要求回答下列问题。
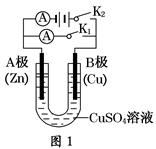 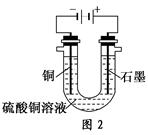
(1)根据图1回答①②:
①若断开K2,闭合K1。
A电极可观察到的现象________________________________________________;
B极的电极反应式为__________________________________________________。
②若断开K1,闭合K2,A电极可观察到的现象是________________;B极的电极反应式为____________。
(2)根据图2回答③④:
③将较纯净的CuSO4溶液放入如图所示的装置中进行电解,石墨电极上的电极反应式为________________,电解反应的离子方程式为________________。
④实验完成后,铜电极增重a g,石墨电极产生标准状况下的气体体积________L。
参考答案:(1)①锌不断溶解Cu2++2e-=Cu
②锌极镀上一层红色的铜Cu-2e-=Cu2+
(2)①4OH--4e-=2H2O+O2↑
2Cu2++2H2O 2Cu+O2↑+4H+ ②0.175a 2Cu+O2↑+4H+ ②0.175a
本题解析:(1)①断开K2,闭合K1,则构成原电池。Zn为负极,失去电子变为Zn2+进入溶液;Cu为正极,其电极反应式为Cu2++2e-=Cu。②断开K1,闭合K2,则构成电解池,A极为阴极,有红色铜在Zn极表面析出;B极为阳极,Cu失去电子变成Cu2+进入溶液。
(2)①图2中石墨为阳极,其电极反应式为4OH--4e-=2H2O+O2↑,总电解反应式为
2Cu2++2H2O 2Cu+O2↑+4H+。 2Cu+O2↑+4H+。
②根据转移电子守恒得,
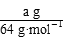 ×2= ×2= ×4 ×4
V=0.175a L。
本题难度:一般
|