|
|
|
高中化学知识点大全《原电池原理》考点强化练习(2017年押题版)(四)
2017-08-06 09:29:37
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某校活动小组为探究金属腐蚀的相关原理,设计了如下图a所示装置,图a的铁棒末段分别连上一块Zn片和Cu片,并静置于含有K3Fe(CN)6及酚酞的混合凝胶上。一段时间后发现凝胶的某些区域(如下图b示)发生了变化,已知Fe2+可用K3Fe(CN)6来检验(呈蓝色)。则下列说法不正确的是


A.甲区呈现红色
B.乙区产生Zn2+
C.丙区发生的电极反应式:Cu-2e-= Cu2+
D.丁区呈现蓝色
|
参考答案:C
本题解析:A、Zn、Fe形成原电池时,Zn为负极,Fe为正极,则甲区为正极,氧气放电,电极反应:O2+2H2O+4e-=4OH-,所以酚酞变红色,A正确;B、乙区为负极,发生电极反应:2Zn-4e-=2Zn2+,产生Zn2+,B正确;C、丙区为正极,发生电极反应:O2+2H2O+4e-=4OH-,C错误;D、丁区为负极,发生电极反应:2Fe-4e-=2Fe2+,生成Fe2+,与K3Fe(CN)6作用呈蓝色,D正确;答案选C。
考点:考查金属的腐蚀及防护。
本题难度:一般
2、实验题 (2014届河北省冀州中学高三3月摸底考试理综化学试卷)
氯碱工业是最基本的化学工业之一,离子膜电解法为目前普遍使用的生产方法,其生产流程如下图所示:
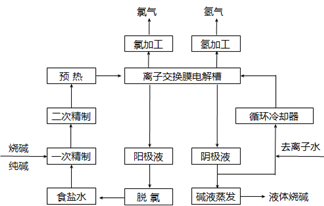
(1)该流程中可以循环的物质是?。
(2)电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有Ca2+、Mg2+、SO42-等无机杂质,所以在进入电解槽前需要进行两次精制,写出一次精制中发生的离子方程式?,若食盐水不经过二次精制就直接进入离子膜电解槽会产生什么后果?。
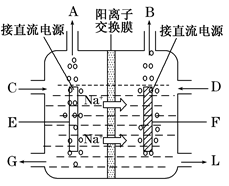
(3)右图是工业上电解饱和食盐水的离子交换膜电解槽示意图(阳极用金属钛网制成,阴极由碳钢网制成)。则B处产生的气体是?,E电极的名称是?。电解总反应的离子方程式为?。
(4)从阳极槽出来的淡盐水中,往往含有少量的溶解氯,需要加入8%~9%的亚硫酸钠溶液将其彻底除去,该反应的化学方程式为?。
(5)已知在电解槽中,每小时通过1安培的直流电可以产生1.492g的烧碱,某工厂用300个电解槽串联生产8小时,制得32%的烧碱溶液(密度为1.342吨/m3)113m3,电解槽的电流强度1.45 ×104A,该电解槽的电解效率为?。
参考答案:(1)氯化钠?氢氧化钠
(2)Ca2++ CO32- = CaCO3↓? Mg2+ + 2OH- = Mg(OH)2↓?用试剂处理后的盐水中还含有少量Mg2+、Ca2+,碱性条件下会生成沉淀,损害离子交换膜。
(3)H2 阳极 ?2Cl-+2H2O Cl2↑+H2↑+2 OH- Cl2↑+H2↑+2 OH-
(4)Na2SO3 + Cl2 + H2O = Na2SO4 + 2HCl
(5)93.46%
本题解析:
氯碱工业的电解原理是2Cl-+2H2O Cl2↑+H2↑+2OH-。(1)从图上看未电解的NaCl和产物NaOH可以循环使用。(2)粗盐水中含有Ca2+、Mg2+、SO42-等无机杂质,一次精制时加入纯碱和烧碱,其中CO32-使Ca2+沉淀,OH-使Mg2+沉淀;用试剂处理后的盐水中还含有少量Mg2+、Ca2+,若食盐水不经过二次精制就直接进入离子膜电解槽,碱性条件下会生成沉淀,损害离子交换膜。 Cl2↑+H2↑+2OH-。(1)从图上看未电解的NaCl和产物NaOH可以循环使用。(2)粗盐水中含有Ca2+、Mg2+、SO42-等无机杂质,一次精制时加入纯碱和烧碱,其中CO32-使Ca2+沉淀,OH-使Mg2+沉淀;用试剂处理后的盐水中还含有少量Mg2+、Ca2+,若食盐水不经过二次精制就直接进入离子膜电解槽,碱性条件下会生成沉淀,损害离子交换膜。
(3)图中Na+由左侧通过离子交换膜进入右侧,说明F电极为H+放电,是阴极,B处产生的气体是H2;
E电极是阳极。电解总反应的离子方程式即电解原理。
(4)溶解氯与亚硫酸钠溶液反应,Cl2变成Cl-,亚硫酸钠变成硫酸钠,注意水参与了反应。
(5)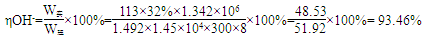
本题难度:一般
3、填空题 (7分)(1)今有氢氧燃料电池,则正极通入的气体是________,负极通入的气体是________,电解质溶液为稀硫酸时,电极反应式为:正极__________?____负极______?______?____,电池的总反应式为?
(2)如把H2改为甲烷、KOH作导电物质,则电极反应式为:负极_________?_______
参考答案:氧气?氢气?略
本题解析:略
本题难度:一般
4、选择题 下列关于如图所示的原电池的有关说法中,正确的是( )
A.Zn是负极,发生还原反应
B.Cu是负极,发生氧化反应
C.锌片上有气体逸出
D.电子由锌片通过导线流向铜片
|
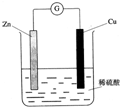
参考答案:A.Zn是负极,发生氧化反应,故A错误;
B.Cu是正极,发生还原反应,故B错误;
C.Cu片上有气体逸出,故C错误;
D.Zn为负极,Cu为正极,则电子由锌片通过导线流向铜片,故D正确;
故选D.
本题解析:
本题难度:简单
5、选择题 下图是氢氧燃料电池构造示意图。下列说法不正确的是
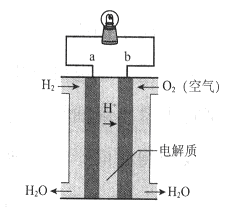
A.a极是负极
B.电子由b通过灯泡流向a
C.该电池总反应是2H2+ O2= 2H2O
D.该装置可将化学能转化为电能
参考答案:B
本题解析:原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。因此在氢氧燃料电池中,氢气在负极通入,氧气在正极通入,则a电极是负极,b电极是正极,A正确;电子由a通过灯泡流向b,B不正确;该电池的正反应就是氢气和氧气反应生成水,即2H2+ O2=2H2O,C正确;原电池是把化学能转化为电能的装置,D正确,答案选B。
点评:该题是基础性试题的考查,难度不大。明确原电池的工作原理是答题的关键,注意电极名称和电极反应式的判断与书写,注意相关知识的积累和总结。
本题难度:一般

