微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (6分)熔融盐燃料电池具有高的发电效率,因而受到重视,可用Li2CO3、Na2CO3和的熔融盐混和物作电解质,CO为阳极燃气,空气与CO2的混和气为阴极助燃气,制得在650℃下工作的燃料电池,完成有关的电池反应式:电池反应式:阳极反应式:2CO+2CO32- →4CO2+4e-。
阴极反应式: ,
电池总反应: 。
参考答案:
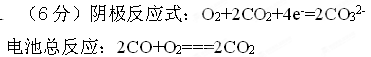
本题解析:
先写出总反应:2CO+O2=2CO2,减去阳极反应,得阴极反应式:O2+2CO2+4e
本题难度:一般
2、选择题 2009年8月15日,陕西省凤翔县政府新闻发布会宣布,东岭冶炼公司是导致凤翔县长青镇部分儿童血铅超标的主要原因。血铅超标,可致免疫力低下、学习困难、智商水平下降等症状。下列关于铅的说法正确的是? (? )
A.铅位于周期表中的第7周期、ⅣA
B.二氧化碳?二氧化铅均有很强的氧化性
C.与铅同主族的单质均能导电
D.在铅蓄电池中,负极电极方程式为:Pb + SO42--2e- =PbSO4
参考答案:D
本题解析:A:铅为第五周期第IVA族元素
B:二氧化碳的氧化性比较弱
C:金刚石不具有导电性
D:正确
本题难度:一般
3、填空题 我国“神舟”五号载人宇宙飞船成功发射并收回,成为我国航天史上重要的里程碑。飞船上使用了氢氧燃料电池。其构造见下图,两极由多孔性碳制成,通入的气体由孔隙中逸出并在电极表面放电。a极是_____极,b极是_____极(填“正”或“负”),电极反应式为:
a极__________________; b极_____________________。
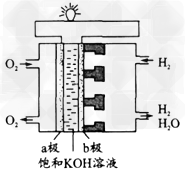
参考答案:正;负;2H2O+O2+4e-=4OH-;2H2+4OH--4e-=4H2O
本题解析:
本题难度:一般
4、填空题 (14分)
(1)燃料电池作为绿色能源得到迅速发展,二甲醚(CH3OCH3)质子交换膜燃料电池的电池反应为:CH3OCH3+3O2 2CO2+3H2O,制取二甲醚的反应如下:
2CO2+3H2O,制取二甲醚的反应如下:
CO(g)+H2O(g) CO2(g)+H2(g)?△H=-41.2kJ·mol-1
CO2(g)+H2(g)?△H=-41.2kJ·mol-1
CO(g)+2H2(g) CH3OH(g)?△H=-90.7kJ·mol-1
CH3OH(g)?△H=-90.7kJ·mol-1
2CH3OH(g) CH3OCH3(g)+H2O(g)?△H=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g)?△H=-23.5kJ·mol-1
①写出由CO和H2制取二甲醚和CO2的热化学方程式:?。
②二甲醚质子交换膜燃料电池是以酸性溶液为电解质溶液,二甲醚从一个电极通入,O2从另一电极通入,中间为质子交换膜,通入O2的一极为?极,电极反应式为?
(2)钢铁工业是国家工业的基础。请回答钢铁冶炼、腐蚀、防护过程的有关问题。
①工业用热还原法炼铁,写出由CO还原赤铁矿(主要成分为Fe2O3)的化学方程式:
_________________________________________________________
②生产中可用盐酸来除铁锈。现将 一生锈的铁片放入盐酸中,当铁锈被除尽后,溶液中发生的化合反应的化学方程式____________________________________________________
一生锈的铁片放入盐酸中,当铁锈被除尽后,溶液中发生的化合反应的化学方程式____________________________________________________
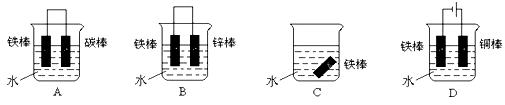
③下列哪个装置可防止铁棒被腐蚀_____________
④在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如下,请回答:
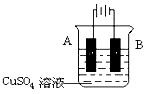
A电极对应的金属是?(写元素名称),
B电极的电极反应式是? ________________?
参考答案:
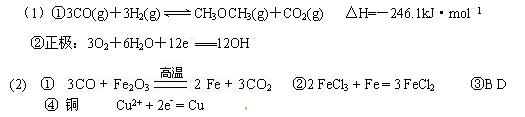
本题解析:略
本题难度:一般
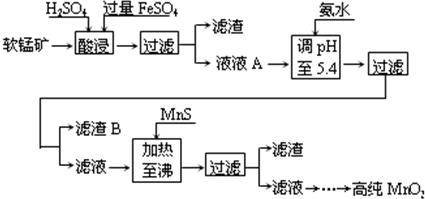
5、简答题 二氧化锰是制造锌锰干电池的基本材料.工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下:
某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物.部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表.
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Pb(OH)2 | Mn(OH)2 | PbS | CuS | ZnS | MnS | FeS
pH
5.2
3.2
9.7
8.7
10.4
≥0.1
≥-0.42
≥2.5
≥7
≥7
|
回答下列问题:
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为______.
(2)滤渣B的主要成分是______.
(3)加入MnS的目的是除去______杂质.
(4)碱性锌锰电池中,MnO2参与的电极反应方程式为______.
参考答案:(1)根据FeSO4在反应条件下将MnO2还原为MnSO4,Fe2+被氧化为Fe3+,故酸浸时生成硫酸锰、硫酸铁,根据元素守恒还有水生成,反应方程式为2FeSO4+MnO2+2H2SO4=MnSO4+Fe2(SO4)3+2H2O.
故答案为:2FeSO4+MnO2+2H2SO4=MnSO4+Fe2(SO4)3+2H2O.
(2)酸浸后的过滤液中含有Mn2+、Fe3+、Al3+、Cu2+、Zn2+、Fe2+,加氨水调pH至5.4,结合题中阳离子以氢氧化物形式完全沉淀时溶液的pH可知,Fe3+、Al3+完全转化为Fe(OH)3和Al(OH)3沉淀,其它离子不沉淀,故滤渣B的主要成分为
Fe(OH)3和Al(OH)3.
故答案为:Fe(OH)3和Al(OH)3.
(3)根据题中硫化物的Ksp可知,加入MnS是为了生成溶解度更小的CuS、ZnS而除去Cu2+、Zn2+.
故答案为:Cu2+、Zn2+.
(4)碱性锌锰干电池中Zn作负极,则MnO2作正极得电子,其电极反应式应为MnO2+H2O+e-=MnOOH+OH-.
故答案为:MnO2+H2O+e-=MnOOH+OH-.
本题解析:
本题难度:一般