微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 工业上利用氢气在氯气中燃烧,将所得产物溶于水制备盐酸。有人设想利用原电池原理直接制备盐酸的同时获取电能,假设这种想法可行,下列说法肯定错误的是
A.两极材料都用金属铂,用一定浓度的盐酸做电解质溶液
B.通入氯气的电极为原电池的正极
C.该方法可将化学能完全转化为电能
D.通氢气的电极发生的反应为:H2 → 2H++2e-
参考答案:C
本题解析:略
本题难度:一般
2、填空题 氨气在科研、生产中有广泛应用。
 ?
?
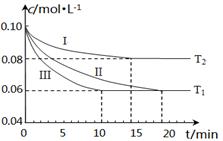
(1)在三个1L的恒容密闭容器中,分别加入0.1mol N2和0.3mol H2发生反应N2(g)+3H2(g) 2NH3(g)ΔH1<0,实验Ⅰ、Ⅱ、Ⅲ中c(N2)随时间(t)的变化如图所示(T表示温度)。
2NH3(g)ΔH1<0,实验Ⅰ、Ⅱ、Ⅲ中c(N2)随时间(t)的变化如图所示(T表示温度)。
①实验Ⅲ在前10分钟内N2平均反应速率v(N2)=?;(写出计算过程)
②与实验Ⅱ相比,实验Ⅰ、实验Ⅲ分别采用的实验条件可能为?、?。
(2)常温下NH4+(aq)+H2O(l) NH3?H2O(aq)+H+(aq)的化学平衡常数为5.55×10-10 mol·L-1,则NH3?H2O的电离平衡常数K=?(保留三位有效数字)。
NH3?H2O(aq)+H+(aq)的化学平衡常数为5.55×10-10 mol·L-1,则NH3?H2O的电离平衡常数K=?(保留三位有效数字)。
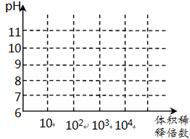
(3)常温下,将1mL pH均为11的氨水与NaOH溶液分别加水稀释,请在右图中画出两溶液的pH随体积稀释倍数的变化曲线(加必要标注)。
(4)工业上用NH3消除NO污染。在一定条件下,已知每还原1molNO,放出热量120kJ,请完成下列热化学方程式: ?NO(g)+?NH3(g)=?N2(g)+??(g)?ΔH2=?。
参考答案:(1)①v(N2)=" Δ" c (N2) /Δt="(0.10-0.06" )mol·L-1/10min=0.004(或4×10-3) mol·L-1·min-1(代数式1分,结果表达1分,带单位运算1分。共3分)?②升高温度、使用催化剂(各2分,共4分)
(2)1.80×10-5mol·L-1(2分,无单位扣1分)。
(3)(见右图)(2分)

(4)6NO(g)+4NH3(g)=5N2(g)+6H2O(g) (2分)ΔH2=-720 kJ/mo1。(2分,没负号扣1分)
或者3NO(g)+2NH3(g)=5/2N2(g)+3H2O(g)?ΔH2=-360 kJ/mo1
本题解析: (1)①从图像可以看出10分钟内氮气的变化量,因此反应速率v(N2)=Δ c (N2) /Δt="(0.10-0.06" )mol·L-1/10min=0.004(或4×10-3) mol·L-1·min-1 ;
②与实验II相比,曲线I更快达到平衡,但氮气的平衡转化率要低,而该反应是吸热反应,因此改变的条件应该是升高了反应的温度;与实验II相比,曲线III反应速率也更快达到平衡,但是平衡转化率不同,因此改变的条件应该是加入了催化剂。
(2)已知的反应式为NH4+ 的水解平衡式,该反应式可以由水的电力平衡式和氨水的电离平衡式结合而得,因此现在要求氨水的电离平衡,只要用水的电力平衡式H2O(l) H+(aq)+OH-(aq)减去已知的水解平衡式即可,相应的平衡常数K(NH3?H2O)=Kw/Kh=1×10-14 /5.55×10-10 =1.80×10-5 mol·L-1 ?。
H+(aq)+OH-(aq)减去已知的水解平衡式即可,相应的平衡常数K(NH3?H2O)=Kw/Kh=1×10-14 /5.55×10-10 =1.80×10-5 mol·L-1 ?。
(3)pH相同的弱碱和强碱溶液稀释,前阶段强碱溶液的pH值等倍数的降低,弱碱溶液边稀释边电离pH降低比强碱要慢,后阶段稀释接近无限稀释,因此溶液的pH值均不再等倍数降低,而是无限的接近7,但是碱溶液始终是碱溶液,pH值不能等于7。因此曲线如图所示。

(4)用氨气做还原剂还原污染物NO,此处氨气中N的化合价由-3→0价,NO中N的化合价由+2→0价,因此根据得失电子守恒配平方程式为6NO(g)+4NH3(g)=5N2(g)+6H2O(g),方程式中NO的系数是6,表示还原NO为6mol,因此热效应ΔH2=6×120kJ=720kJ/mol。由于热化学方程式中系数可以是分数,因此答案也可以是3NO(g)+2NH3(g)=5/2N2(g)+3H2O(g)?ΔH2=-360 kJ/mo1。
本题难度:困难
3、填空题 利用Cu+ 2FeCl3=CuCl2+ 2FeCl2反应,设计一个原电池。
(1)写出电极反应式:负极?。
正极?。
(2)在下面的烧杯中画出装置图,并作必要的标注:
参考答案:(8分)(1)Cu-2e-=Cu2+?(2分) ;2Fe3+ + 2e==2Fe2+?(2分)
(2)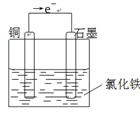 ?(4分)
?(4分)
本题解析:原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。根据方程式可知,铜失去电子,是还原剂,做负极,电极反应式是Cu-2e-=Cu2+。正极材料是金属性弱于铜的金属或石墨,而电解质溶液可以是氯化铁,正极电极反应式 2Fe3+ + 2e==2Fe2+,装置图如下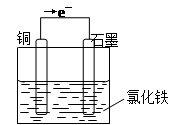 。
。
点评:该题是基础性试题的考查,难度不大。该题的关键是明确原电池的构造原理,然后结合题意灵活运用即可,有利于培养学生的逻辑推理能力和规范答题能力。
本题难度:一般
4、选择题 常温下,在a、b、c三个盛有相同体积、相同浓度的稀H2SO4的烧杯中,分别加入等质量的表面积相同的锌。然后在a中同时加入适量CuSO4溶液,c中加入适量的无水CH3COONa固体。下列各图中表示其产生氢气总体积(V)与时间(t)的关系,其中可能正确的是?
[? ]
A.
B.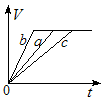
C.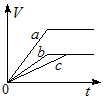
D.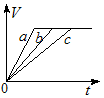
参考答案:AD
本题解析:
本题难度:一般
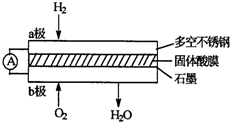
5、选择题 某固体酸燃料电池以Ca(HSO4)2固体为电解质传递H+,其基本结构见图,电池总反应可表示为:2H2+O2═2H2O,下列有关说法正确的是( )
A.电子通过外电路从b极流向a极
B.b极上的电极反应式为:O2+2H2O+4e-═4OH-
C.每转移0.1mol电子,消耗1.12L的H2
D.H+由a极通过固体酸电解质传递到b极