| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点大全《水的电离平衡》高频试题巩固(2017年最新版)(四)
参考答案:D 本题解析:D项:等体积混合,溶液的体积扩到了二倍,浓度缩小了二倍,故C(H+)= C(A-)= C(B+)= C(OH-)=0.05mol·L-1,故错。故选D。 本题难度:困难 2、选择题 25℃时,水的电离达到平衡:H2O?H++OH-;△H>0,下列叙述正确的是( ) 参考答案:BC 本题解析: 本题难度:简单 3、选择题 将pH=4的酸溶液与pH=10的NaOH溶液等体积混合后,溶液的pH可能是 |
参考答案:D
本题解析:若酸为强酸,则pH=4的酸溶液与pH=10的NaOH溶液等体积混合后,溶液的pH等于7;若酸为弱酸,则pH=4的酸溶液与pH=10的NaOH溶液等体积混合后,溶液的pH小于7 ;
本题难度:一般
4、填空题 (4分)在温度T下,c(OH-)=0.1 mol·L-1的Ba(OH)2的PH值为11。
(1)该温度下,100ml水中含有OH-约有_ 个。
(2)该温度下,在PH=8的Ba(OH)2溶液中加入PH=5的盐酸,欲使混合溶液pH=7,则Ba(OH)2溶液与所加盐酸的体积比为__ __
参考答案:(4分)(1)_ 10-7 NA 个(2)__2:9
本题解析:因为题目告诉PH=11,所以H+浓度应为10-11mol/L。根据溶液离子积的算法:KW=C(H+)×C(OH-)=10-11×10-1=10-12。
(1)该温度下,水是中性,OH-浓度等于H+浓度,根据上面算出的离子积可推知,C(OH-)=10-6,物质的量应为10-7,再根据N/NA=n,可得100ml水中含有OH-约有10-7 NA。
(2)溶液混合后PH=7,根据离子积常数,可判断该溶液应该是碱性溶液。设Ba(OH)2溶液体积为V1,盐酸溶液体积V2,再依据混合溶液PH值计算方法列出计算式:[C(OH-)×V1—C(H+)×V2]/(V1+V2)=10-5。由该计算式可得V1/V2=2/9
本题难度:一般
5、填空题 Ⅰ.氮化硅是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
3SiO2+6C+2N2 Si3N4+6CO;DH <0。
Si3N4+6CO;DH <0。
(1)在容积固定的密闭容器中,分别在三种不同的实验条件下进行上述制备反应,测得N2的物质的量浓度随时间的变化如图所示,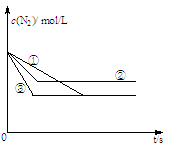
②和③分别仅改变一种反应条件。所改变的条件分别是:② ;③ 。
(2)1 000℃时,在2 L密闭容器中进行上述反应,若起始时N2浓度为4.0 mol/L,经1小时反应达到平衡状态,此时容器内气体总浓度为10.0 mol/L,则以CO表示的反应速率为 。
Ⅱ.图为Mg—NaClO燃料电池结构示意图。
已知电解质溶液为NaOH溶液,且两电极中有一电极为石墨电极。
(1)Y电极材料为 。
(2)X电极发生的电极反应式为 。
(3)若该电池开始时加入1L 0.2mol/L的NaOH溶液,然后从下口充入1L 0.1mol/L的NaClO溶液(忽略整个过程的体积变化),当NaClO完全放电时溶液的pH= 。
参考答案:(各2分 共12分)Ⅰ (1)升温或通CO 加入催化剂 (2)0.15 mol·L-1·min-1
Ⅱ(1)Mg (2)ClO—+2e—+H2O=Cl—+2OH— (3) 13
本题解析:Ⅰ (1)根据图像可知,曲线②③达到平衡的时间均小于曲线①达到平衡的时间,说明反应速率快。其中曲线②平衡时氮气的浓度大,而曲线③平衡时氮气浓度不变。由于正方应 是体积增大的放热反应,则②改变的条件应该是升高温度或通CO,而③改变的条件应该是加入催化剂;
(2)3SiO2+6C+2N2 Si3N4+6CO
Si3N4+6CO
起始浓度(mol/L) 4 0
转化浓度(mol/L) x 3x
平衡浓度(mol/L) 4-x 3x
平衡时容器内气体总浓度为10.0 mol/L,则4-x+3x=10,解得x=3,所以以CO表示的反应速率为9mol/L÷60min=0.15 mol·L-1·min-1。
Ⅱ(1)根据装置图可知,电池中氢氧根离子向Y电极移动,则Y电极是负极。镁是活泼的金属作负极,则Y电极是Mg;
(2)X电极是正极,次氯酸根在正极得到电子发生还原反应,则电极反应式为ClO—+2e—+H2O=Cl—+2OH— ;
(3)1L 0.1mol/L的NaClO溶液中次氯酸钠的物质的量是0.1mol,根据电极反应式ClO—+2e—+H2O=Cl—+2OH— 可知产生0.2mol氢氧根离子。1L 0.2mol/L的NaOH溶液中氢氧根离子的物质的量是0.2mol,所以完全反应后溶液中氢氧根离子的物质的量是0.4mol,但其中有0.2mol氢氧根离子与负极产生的镁离子结合生成氢氧化镁沉淀,所以溶液中氢氧根离子的浓度是0.2mol÷2L=0.1mol/L,则溶液pH=13。
考点:考查反应速率、外界条件对平衡状态的影响以及原电池原理的应用
本题难度:困难
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点大全《氧化还原反.. | |