微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 碳原子的基态外围电子排布式正确的是
[? ]
A.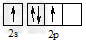
B.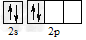
C.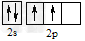
D.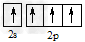
参考答案:C
本题解析:
本题难度:简单
2、简答题 下图为长式周期表的一部分,其中的编号代表对应的元素.
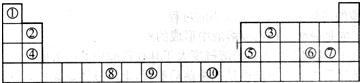
请回答下列问题:
(1)表中属于ds区的元素是______(填编号).
(2)表中元素①的2个原子与元素③的2个原子形成的分子中元素③的杂化类型是______;③和⑦形成的常见化合物的化学键类型是______.
(3)元素⑧的外围电子排布式为______,该元素原子中未成对电子数为______.
(4)在周期表中位于对角线的元素的性质也有一定的相似性.试写出元素②的氢氧化物与NaOH溶液反应的化学方程式:______.
(5)在1183K以下,元素⑨形成如图1所示基本结构单元的晶体;1183K以上,转变为图2所示基本结构单元的晶体.
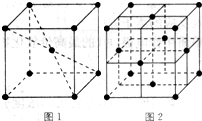
在1183K以下的晶体中,与元素⑨的原子等距离且最近的原子数为______;
在1183K以上的晶体中,与元素⑨的原子等距离且最近的原子数为______.
参考答案:(1)处于ds区的元素为第ⅠB和ⅡB,其中⑩位于第ⅠB,故属于ds区的元素为⑩,故答案为:⑩;
(2)元素①为氢元素,元素③为碳元素,2个氢原子与的2个碳原子形成的分子中为乙烯,元素碳的杂化类型是sp杂化;
?元素③为碳元素和元素⑦氯元素形成的常见化合物为四氯化碳,四氯化碳的化学键类型是极性共价键,故答案为:sp;极性共价键;
(3)元素⑧为铬元素,位于第四周期第ⅥB族,价电子为六个,排布在s和d上,d上排五个电子形成半充满结构,比较稳定,故其外围电子排布式为3d54s1,六个电子均为单电子,故单电子数为?6个,故答案为:3d54s1;6;
(4)在周期表中位于对角线的元素的性质有一定的相似性,根据对角线法则,铍元素与铝元素具有一定的相似性,氢氧化铝为两性氢氧化物,故氢氧化铍也为两性氢氧化物,生成相应的偏铍酸盐,化学方程式为2NaOH+Be(OH)2═Na2BeO2+2H2O,故答案为:2NaOH+Be(OH)2═Na2BeO2+2H2O;
(5)在1183K以下,为左图所示,可知体心中有一个原子周围有八个原子,故每个晶胞中有8个原子与中心原子等距离且最近,在晶体中依然为8个,在1183K以上时为右图所示,以最上面中间原子为为例,同一个平面上有4个原子距离相等且距离最小,在竖直方向的四个面上,中间原子与所选定原子等距离且距离最小,在晶体中晶胞重复出现,故对面会有对称的四个竖直面上的点,一共12个,故答案为:8;12.
本题解析:
本题难度:一般
3、填空题 (二选一)【物质结构与性质】
能源、材料和信息是现代社会的三大“支柱”。
(1)目前,利用金属或合金储氢的研究已取得很大进展,下图是一种镍基合金储氢后的晶胞结构图。
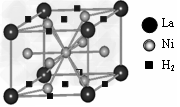
①?Ni原子的价电子排布式是______________。
②?该合金储氢后,含1mol?La的合金可吸附H2的物质的量为__________。
(2)南师大结构化学实验室合成了一种多功能材料--对硝基苯酚水合物(化学式为C6H5NO3·1.5H2O)。实验表明,加热至94℃时该晶体能失去结晶水,由黄色变成鲜亮的红色,在空气中温度降低又变为黄色,具有可逆热色性;同时实验还表明它具有使激光倍频的二阶非线性光学性质。
①晶体中四种基本元素的电负性由大到小的顺序是_________________。
②对硝基苯酚水合物失去结晶水的过程中,破坏的微粒间作用力是_______________。
(3)科学家把NaNO3和Na2O在一定条件下反应得到一种白色晶体,已知其中阴离子与
SO42-互为等电子体,且该阴离子中的各原子的最外层电子都满足8电子稳定结构。 该阴离子的电子式是__________,其中心原子N的杂化方式是_________?。
参考答案:(1)①?3d84s2;②?3?mol?
(2)①?O>N>C>H;②?氢键
(3) ;sp3
;sp3
本题解析:
本题难度:一般
4、填空题 (二选一)【物质结构与性质】
能源、材料和信息是现代社会的三大“支柱”。
(1)目前,利用金属或合金储氢的研究已取得很大进展,图11是一种镍基合金储氢后的晶胞结构图。
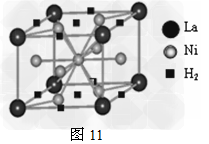
①?Ni原子的价电子排布式是________________。
②?该合金储氢后,含1mol?La的合金可吸附H2的物质的量为___________________。
(2)南师大结构化学实验室合成了一种多功能材料--对硝基苯酚水合物(化学式为C6H5NO3·1.5H2O)。实验表明,加热至94℃时该晶体能失去结晶水,由黄色变成鲜亮的红色,在空气中温度降低又变为黄色,具有可逆热色性;同时实验还表明它具有使激光倍频的二阶非线性光学性质。
①晶体中四种基本元素的电负性由大到小的顺序是__________________。
②对硝基苯酚水合物失去结晶水的过程中,破坏的微粒间作用力是______________。
(3)科学家把NaNO3和Na2O在一定条件下反应得到一种白色晶体,已知其中阴离子与SO42-互为等电子体,且该阴离子中的各原子的最外层电子都满足8电子稳定结构。该阴离子的电子式是_____________,其中心原子N的杂化方式是_______________。
参考答案:(1)① 3d84s2;② 3 mol?
(2)① O >N >C >H;② 氢键
(3)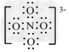 ;sp3
;sp3
本题解析:
本题难度:一般
5、选择题 下列关于杂化轨道的叙述中,正确的是
[? ]
A.分子中的中心原子通过sp3杂化轨道成键时,该分子一定为正四面体结构
B.CCl4分子中有四个完全等同的sp3-pσ键
C.杂化轨道一般只用于形成σ键或用于容纳未参与成键的孤对电子
D.杂化轨道理论与VSEPR模型分析分子的空间构型结果常常相互矛盾
参考答案:BC
本题解析:
本题难度:一般