微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 雷尼镍( Raney-Ni)是一种历史悠久、应用广泛的催化剂,由镍一铝合金为原料制得。
(1)元素第一电离能:Al________Mg(填“>”、“<”或“=”)。
(2)雷尼镍催化的一实例为
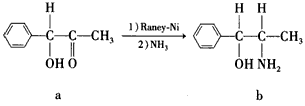
化合物b中采取sp3杂化的原子有:___________
(3)一种铝镍合金的结构如下图,与其结构相似的化合物是__________(选填序号)。
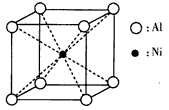
a.氯化钠 b.氯化铯 c.石英 d.金刚石
(4)实验室检验Ni2+可用丁二酮肟与之作用生成猩红色配合物沉淀。
①Ni2+在基态时,核外电子排布式为__________
②在配合物中用配位键和氢键标出未画出的作用力(镍的配位数为4)。

2、填空题 原子序数依次递增的甲、乙、丙、丁、戊是周期表中前30号元素,其中甲、乙、丙三元素的基态原子2p能级都有单电子,单电子个数分别是2、3、2;丁与戊原子序数相差18,戊元素是周期表中ds区的第一种元素。
回答下列问题:
(1)甲能形成多种常见单质,在熔点较低的单质中,每个分子周围紧邻的分子数___ ;在熔点很高的两种常见单质中,X的杂化方式分别为? 、? 。
(2)14g乙的单质分子中π键的个数为___________。
(3)+1价气态基态阳离子再失去一个电子形成+2价气态基态阳离子所需要的能量称为第二电离能I2,依次还有I3、I4、I5…,推测丁元素的电离能突增应出现在第? 电离能。
(4)戊的基态原子有? 种形状不同的原子轨道;
(5)丙和丁形成的一种离子化合物的晶胞结构如下图,该晶体中阳离子的配位数为? 。距一个阴离子周围最近的所有阳离子为顶点构成的几何体为? 。已知该晶胞的密度为ρ g/cm3,阿伏加德罗常数为NA,求晶胞边长a=__________cm。 (用含ρ、NA的计算式表示)

(6)甲、乙都能和丙形成原子个数比为1:3的常见微粒,推测这两种微粒的空间构型为_________。
3、选择题 下列关于杂化轨道的叙述中,不正确的是
[? ]
A.分子中中心原子通过SP3杂化轨道成键时,该分子不一定为正四面体结构
B.杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子
C.H2SO4硫酸分子中三种原子均以杂化轨道成键
D.N2分子中N原子没有杂化,分子中有一个σ键、2个π键
4、选择题 下列关于杂化轨道与分子构型的说法中正确的是
[? ]
A.凡是中心原子采取sp3杂化轨道成键的分子,其空间构型都是正四面体形
B.BeCl2分子中的sp杂化轨道是由Be原子的s轨道和Cl原子的p轨道混合起来形成的
C.sp3杂化轨道是由同一个原子中能量相近的s轨道和p轨道混合起来形成的一组能量相近的新轨道
D.凡是AB3型分子,其中心原子A均采取sp3杂化轨道成键
5、选择题 下列分子或离子的中心原子没有采取sp3杂化的是?
[? ]
A.晶体硅中的硅原子?
B.NH4+?
C.BF3?
D.ClO4-