微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在5L的密闭容器中,含有等物质的量的PCl3和Cl2其合成反应为PCl3(g)+Cl2(g) PCl5(g)。当
PCl5(g)。当
250℃达到平衡后,PCl5的分压为1atm时,原来含有PCl3和Cl2的物质的量(单位:mol)分别是(Kp=0.54)
[? ]
A.1,1
B.0.276, 0.38
C.0.5 ,0.6
D.0.276 ,0.276
参考答案:D
本题解析:
本题难度:一般
2、选择题 在恒温时,一固定容积的容器内发生如下反应:2NO2(g) N2O4(g) 达到平衡时,再向容器内通入一定量的NO2(g),重新达到平衡后,与第一次平衡时相比,NO2的体积分数
N2O4(g) 达到平衡时,再向容器内通入一定量的NO2(g),重新达到平衡后,与第一次平衡时相比,NO2的体积分数
A.不变
B.增大
C.减小
D.无法判断
参考答案:C
本题解析:由于反应物和生成物都是一种,所以达到平衡时,再向容器内通入一定量的NO2(g),则相当于是增大压强,平衡向正反应方向移动,NO2的体积分数减少,答案选C。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生基础知识的巩固和训练。该题的关键是理解并能灵活运用勒夏特列原理,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力。
本题难度:简单
3、选择题 在恒容密闭容器中有可逆反应:nA(g) + mB(g) 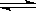 ?pC(g)? m+n>p,(正反应吸热)处于平衡状态,对该平衡的下列说法正确的是
?pC(g)? m+n>p,(正反应吸热)处于平衡状态,对该平衡的下列说法正确的是
A.升高温度,c(B)/c(C)的比值减小
B.加入B,A和B的转化率均增大
C.充入C,A和B的物质的量浓度增大,达到平衡时A的质量百分含量减小
D.降温时,混合气体的平均相对分子质量增大
参考答案:A
本题解析:A正确;B错,加入B,A的转化率均增大,B的转化率减小;C错,充入C,A和B的物质的量浓度增大,达到平衡时A的质量百分含量增大;D错,.降温时,平衡向逆反应方向移动,混合气体的平均相对分子质量减小;
本题难度:一般
4、填空题 (10分)在一定条件下的下列可逆反应达到平衡时,试填出:xA+yB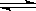 zC
zC
(1)若A、B、C都是气体,增大压强,平衡向正反应方向移动,则x+y与z关系是_____?__;
(2)若A、C是气体,且x+y=z,在加压时化学平衡可发生移动,则平衡必定是向?方向移动;
(3)若B、C是气体,A是固体,增大A的浓度,平衡?(填“正向移动”、“逆向移动”或“不移动”);
(4)若升高温度后,C的百分含量减小,则正反应是?(填“吸热”或“放热”)反应。
(5)若该可逆反应达到平衡时加入催化剂,平衡?(填“正向移动”、“逆向移动”或“不移动”);
参考答案:(1)x + y > z?(2)逆(3)不移动?(4)放热?(5)不移动
本题解析:(1)A、B、C都是气体,增大压强,平衡向气体分子数减少的方向移动,所以x + y > z。
(2)x+y=z,所以z>x,A、C是气体,所以加压时平衡向逆反应方向移动。
(3)增大固体物质的量,化学反应速率不变,对平衡移动无影响。
(4)升高温度,C的百分含量减小,说明升高温度平衡向左移动,逆反应是吸热反应,正反应是放热反应。
(5)催化剂同等程度改变正、逆反应速率,对平衡移动无影响。
点评:增加固体或纯液体的量,对平衡移动无影响。
本题难度:一般
5、选择题 有一处于平衡状态的反应:A(g)+3D(g) 2E(g);ΔH<0。为了使平衡向生成E的方向移动,最适宜的条件是①高温;②低温;③高压;④低压;⑤加催化剂;⑥除去E。
2E(g);ΔH<0。为了使平衡向生成E的方向移动,最适宜的条件是①高温;②低温;③高压;④低压;⑤加催化剂;⑥除去E。
A.①、③和⑥
B.②、③和⑥
C.①、④和⑥
D.②、③、⑤和⑥
参考答案:B
本题解析:反应A(g)+3D(g) 2E(g),ΔH<0,是一个放热反应,所以升高温度,平衡逆向移动,降低温度,平衡正向移动,故①错误,②正确;增大压强,平衡向着气体体积减小的方向即逆向进行,减小压强,平衡正向移动,故③正确;④错误;加催化剂不会引起化学平衡的移动,故⑤错误;分离出E,即减小生成物的浓度,平衡正向移动,故⑥正确.故选B。
2E(g),ΔH<0,是一个放热反应,所以升高温度,平衡逆向移动,降低温度,平衡正向移动,故①错误,②正确;增大压强,平衡向着气体体积减小的方向即逆向进行,减小压强,平衡正向移动,故③正确;④错误;加催化剂不会引起化学平衡的移动,故⑤错误;分离出E,即减小生成物的浓度,平衡正向移动,故⑥正确.故选B。
点评:根据影响化学平衡移动的因素:温度、压强、浓度等回答。
本题难度:简单