微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 难挥发性二硫化钽(TaS2 )可采用如下装置提纯。将不纯的TaS2 粉末装入石英管一端,抽真空后引入适量碘并封管,置于加热炉中。反应如下: TaS2(g)+ 2I2(g)TaI4(g) + S2(g),下列说法错误的是

A.在不同温度区域,TaI4 的量不同
B.在提纯过程中,S2 的量不断增多
C.该反应的平衡常数不随TaI4 和S2 的浓度增大而增大
D.在提纯过程中,I2 的作用是将TaS2 从高温区转移到低温区
参考答案:B
本题解析:A、因为在不同的温度下,平衡是不一样的,因此在不同温度区域,TaI4 的量不同,正确;B、在提纯过程中,一开始S2 的量不断的增多,但是后期S2 的量不断减少,错误;[C、在一定温度下,平衡常数是定值该反应的平衡常数不随TaI4 和S2 的浓度增大而增大,正确;D、在提纯过程中,I2 的作用是将TaS2 从高温区转移到低温区,正确。
本题难度:一般
2、计算题 (6分) 在一定温度下,将0.20 mol 的四氧化二氮气体充入1L的固定的密闭容器中,每隔一段时间对该容器内的物质进行一次分析,得到如下数据:
 ? ?
时间 (s)浓度 mol·L-1
| 0
| 20
| 40
| 60
| 80
| 100
|
C(N2O4)
| 0.20
| C1
| 0.10
| C3
| C4
| C5
|
C(NO2)
| 0.00
| 0.12
| C2
| 0.22
| 0.22
| 0.22
|
?
根据表格提供数据,请回答下列各小题:
⑴该反应的化学方程式为:?
表示C2?C3?C4 (填 < , > 或 = )
⑵ 20S时,四氧化二氮的浓度C1= ??
在0~20 S内四氧化二氮的平均反应速度为?
参考答案:(1) N2O4 ?2NO2? C2?>? C3?=? C4
?2NO2? C2?>? C3?=? C4
(2)0.14mol/L? 0.003mol/(L·s)
本题解析:(1)根据表中数据可判断,平衡时NO2的浓度是0.22mol/L,根据反应式可知消耗N2O4的浓度应是0.11mol/L,所以平衡时N2O4的浓度是0.20mol/L-0.11mol/L=0.09mol/L。即C3=C4=0.09mol/L。反应进行到40s时N2O4的浓度是0.10mol/L,则消耗N2O4的浓度是0.20mol/L-0.10mol/L=0.10mol/L,所以此时生成的NO2浓度是0.20mol/L,即C2=0.20mol/L。
(2)20s时NO2的浓度是0.12mol/L,根据反应式可知消耗N2O4的浓度应是0.06mol/L,所以剩余N2O4的浓度是0.20mol/L-0.06mol/L=0.14mol/L。在0~20s内四氧化二氮的平均反应速度为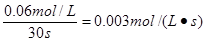 。
。
本题难度:一般
3、选择题 将1 mol SO2和1mol O2通入一容积不变的密闭容器中,在一定温度和催化剂作用下,发生反应:2SO2(g)+O2(g) 2SO3(g)。反应达到平衡时SO3为0.3 mol。若此时移走0.5 mol O2和0.5 mol SO2,则重新达到平衡后,SO3的物质的量
2SO3(g)。反应达到平衡时SO3为0.3 mol。若此时移走0.5 mol O2和0.5 mol SO2,则重新达到平衡后,SO3的物质的量
A.等于0.3 mol
B.等于0.15 mol
C.小于0.15 mol
D.大于0.15 mol,小于0.3 mol
参考答案:C
本题解析:移走0.5 mol O2和0.5 mol SO2相当于对容器进行减压一半操作,因此平衡逆向移动,所以SO3的物质的量小于0.15 mol。答案选C。
点评:改变影响移动的一个条件,平衡向减弱这种改变的方向移动。
本题难度:一般
4、填空题 (共12分)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
Ⅰ.目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3.25 mol H2,在一定条件下发生反应,测定CO2、CH3OH(g)和H2O(g)的浓度随时间变化如下图所示:
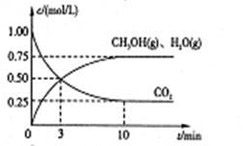
(1)从反应开始到平衡,氢气的平均反应速率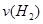 =??mol/(L·min)
=??mol/(L·min)
(2)该条件下CO2的转化率为?。
(3)下列措施中能使n(CH3OH)/n(CO2)增大的是?。
A.升高温度
B.恒容时充入氮气
C.将水蒸气从体系中分离
D.用更有效的催化剂
