微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在火星上工作的美国“勇气号”、“机遇号”探测车的一个重要任务就是收集有关Fe2O3及硫酸盐的信息,以证明火星上存在或曾经存在过水.以下叙述正确的是( )
A.铝热剂就是单指Fe2O3粉末和铝粉的混合物
B.检验从火星上带回来的红色物质是否是Fe2O3的操作步骤为:样品→粉碎→加水溶解→过滤→向滤液中滴加KSCN溶液
C.分别还原a?mol?Fe2O3所需H2、Al、CO的物质的量之比为3:2:3
D.明矾属硫酸盐,含结晶水,是混合物
2、填空题 高铁酸钾(K2FeO4)具有极高的氧化性,对环境无不良影响,被人们称为“绿色化学”试剂.某校化学兴趣小组对高铁酸钾进行了如下探究.
I、高铁酸钾制备:
①在一定温度下,将氯气通入KOH溶液中制得次氯酸钾溶液;②在剧烈搅拌条件下,将Fe(NO3)3?分批加入次氯酸钾溶液中,控制反应温度,以免次氯酸钾分解;③加?KOH至饱和,使K2FeO4?充分析出,再经纯化得产品.
(1)温度过高会导致次氯酸钾分解生成两种化合物,产物之一是氯酸钾(KClO3),此反应化学方程式是______.
(2)制备过程的主反应为(a、b、c、d、e、f为化学计量系数):aFe?(OH)?3+b?ClO-+cOH-=d?FeO42-+e?Cl-+f?H2O,则a:f=______.
II、探究高铁酸钾的某种性质:
实验1:将适量K2FeO4分别溶解于pH?为?4.74、7.00、11.50?的水溶液中,配得FeO42-浓度为?1.0mmol?L-1(1mmol?L-1=10-3mol?L-1)的试样,静置,考察不同初始?pH?的水溶液对K2FeO4某种性质的影响,结果见图1(注:800min后,三种溶液中高铁酸钾的浓度不再改变).
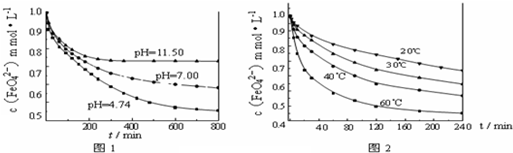
实验2:将适量?K2FeO4?溶解于pH=4.74?的水溶液中,配制成FeO42-浓度为?1.0mmol?L-1?的试样,将试样分别置于?20℃、30℃、40℃和?60℃的恒温水浴中,考察不同温度对K2FeO4某种性质的影响,结果见图2.
(3)实验1的目的是______;
(4)实验2可得出的结论是______;
(5)高铁酸钾在水中的反应为4FeO42-+10H2O?4Fe(OH)3+8OH-+3O2↑.
由图1可知,800min时,pH=11.50的溶液中高铁酸钾最终浓度比pH=4.74的溶液中高,主要原因是______;
Ⅲ、用高铁酸钾作高能电池的电极材料:
Al-K2FeO4电池是一种高能电池(以氢氧化钾为电解质溶液),该电池放电时负极反应式是:______.
3、选择题 某溶液中含有Fe2+和I?-.为了氧化I?-而不使Fe2+被氧化,试根据下列三个反应判断,可选用的氧化剂是( )
①2Fe3++2I-=2Fe2++I2
②2Fe2++Cl2=2Fe3++2Cl-
③2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O.
A.FeCl2
B.KMnO4
C.Cl2
D.FeCl3
4、选择题 (B类)对于反应2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O,若有0.1molKMnO4参加反应,下列说法中正确的是( )
A.还原剂是KMnO4
B.生成Cl25.6L
C.参加反应的HCl为16mol
D.其转移电子为0.5mol
5、选择题 分类法是学习和研究化学的一种常用的科学方法.下列分类合理的是( )
①Fe203、Ca0、C02都是碱性氧化物
②根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应
③根据元素原子最外层电子数的多少将元素分为金属元素和非金属元素
④洁净的空气、纯净的盐酸都是混合物
⑤根据分散系的稳定性将分散系分为胶体、溶液和浊液.
A.只有②④
B.只有①③⑤
C.只有①②④
D.只有②③⑤