微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在火星上工作的美国“勇气号”、“机遇号”探测车的一个重要任务就是收集有关Fe2O3及硫酸盐的信息,以证明火星上存在或曾经存在过水.以下叙述正确的是( )
A.铝热剂就是单指Fe2O3粉末和铝粉的混合物
B.检验从火星上带回来的红色物质是否是Fe2O3的操作步骤为:样品→粉碎→加水溶解→过滤→向滤液中滴加KSCN溶液
C.分别还原a?mol?Fe2O3所需H2、Al、CO的物质的量之比为3:2:3
D.明矾属硫酸盐,含结晶水,是混合物
参考答案:A.作为铝热剂重要组成的金属氧化物,并非单质氧化铁,也并非泛指所有金属氧化物,而是有-定范围的,即指那些难熔的金属氧化物.而这些难熔的金属氧化物和混合物中的铝反应时放出大量热,也是构成铝热反应的一个重要条件,故A错误;
B.Fe2O3不溶于水,且和水不反应,应加入盐酸或稀硫酸溶解后再加KSCN溶液,故B错误;
C.amolFe2O3被还原得到6amol电子,则分别消耗H2、Al、CO3amol、2amol、3amol,物质的量之比为3:2:3,故C正确;
D.明矾为结晶水化合物,为纯净物,故D错误.
故选C.
本题解析:
本题难度:一般
2、填空题 高铁酸钾(K2FeO4)具有极高的氧化性,对环境无不良影响,被人们称为“绿色化学”试剂.某校化学兴趣小组对高铁酸钾进行了如下探究.
I、高铁酸钾制备:
①在一定温度下,将氯气通入KOH溶液中制得次氯酸钾溶液;②在剧烈搅拌条件下,将Fe(NO3)3?分批加入次氯酸钾溶液中,控制反应温度,以免次氯酸钾分解;③加?KOH至饱和,使K2FeO4?充分析出,再经纯化得产品.
(1)温度过高会导致次氯酸钾分解生成两种化合物,产物之一是氯酸钾(KClO3),此反应化学方程式是______.
(2)制备过程的主反应为(a、b、c、d、e、f为化学计量系数):aFe?(OH)?3+b?ClO-+cOH-=d?FeO42-+e?Cl-+f?H2O,则a:f=______.
II、探究高铁酸钾的某种性质:
实验1:将适量K2FeO4分别溶解于pH?为?4.74、7.00、11.50?的水溶液中,配得FeO42-浓度为?1.0mmol?L-1(1mmol?L-1=10-3mol?L-1)的试样,静置,考察不同初始?pH?的水溶液对K2FeO4某种性质的影响,结果见图1(注:800min后,三种溶液中高铁酸钾的浓度不再改变).
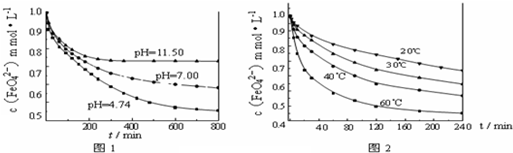
实验2:将适量?K2FeO4?溶解于pH=4.74?的水溶液中,配制成FeO42-浓度为?1.0mmol?L-1?的试样,将试样分别置于?20℃、30℃、40℃和?60℃的恒温水浴中,考察不同温度对K2FeO4某种性质的影响,结果见图2.
(3)实验1的目的是______;
(4)实验2可得出的结论是______;
(5)高铁酸钾在水中的反应为4FeO42-+10H2O?4Fe(OH)3+8OH-+3O2↑.
由图1可知,800min时,pH=11.50的溶液中高铁酸钾最终浓度比pH=4.74的溶液中高,主要原因是______;
Ⅲ、用高铁酸钾作高能电池的电极材料:
Al-K2FeO4电池是一种高能电池(以氢氧化钾为电解质溶液),该电池放电时负极反应式是:______.
参考答案:I、((1)由题意可得KClO→KClO3的过程中Cl从+1价升至+5价,得在KClO生成另一产物的过程中化合价要降低,结合另一产物也为化合物的事实,推测Cl的化合价应降至-1价,故另一产物应为KCl,反应方程式为3KClO=KClO3+2KCl,故答案为:3KClO=KClO3+2KCl;
(2)Fe元素化合价由+3价升至+6价,总共升高3价,Cl元素化合价从+1价降至-1价,总共降低2价,化合价升降最小公倍数为6,所以FeO42-系数为2,Cl-系数为3,根据铁元素守恒确定Fe?(OH)?3系数为2,根据氯元素守恒ClO-系数为3,根据电荷守恒确定OH-系数2×2+3-3=4,根据H元素守恒确定H2O的系数为5,所以a:f=2:5,故答案为:2:5;
II、(3)由图1数据可知,溶液pH越小,相同时间内FeO42-浓度变化越快,高铁酸钾溶液平衡时FeO42-浓度越小.所以实验1的目的是探究高铁酸钾在不同pH溶液中的稳定性(或与水反应的速率),故答案为:探究高铁酸钾在不同pH溶液中的稳定性(或与水反应的速率);
(4)由图2数据可知,温度越高,相同时间内FeO42-浓度变化越快,高铁酸钾溶液平衡时FeO42-浓度越小,
故答案为:温度越高,高铁酸钾越不稳定(或温度越高,高铁酸钾与水反应的速率越快);
(5)高铁酸钾在水中的反应为4FeO42-+10H2O?4Fe(OH)3+8OH-+3O2↑,pH=11.50的溶液中OH-离子浓度大,使上述平衡向左移动,FeO42-浓度增大,
故答案为:pH=11.50的溶液中OH-离子浓度大,使上述平衡向左移动;
Ⅲ、原电池的负极发生氧化反应,Al在负极放电,碱性条件下,生成AlO2-与H2O,电极反应式为Al-3e-+4OH-=AlO2-+2H2O.
故答案为:Al-3e-+4OH-=AlO2-+2H2O.
本题解析:
本题难度:一般
3、选择题 某溶液中含有Fe2+和I?-.为了氧化I?-而不使Fe2+被氧化,试根据下列三个反应判断,可选用的氧化剂是( )
①2Fe3++2I-=2Fe2++I2
②2Fe2++Cl2=2Fe3++2Cl-
③2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O.
A.FeCl2
B.KMnO4
C.Cl2
D.FeCl3
参考答案:①2Fe3++2I-=2Fe2++I2中氧化性Fe3+>I2,还原性I->Fe2+,
②2 Fe2++Cl2=2Fe3++2Cl-中氧化性Cl2>Fe3+,还原性Fe2+>Cl-,
③2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O中氧化性MnO4->Cl2,还原性Cl->Mn2+,
根据以上知,氧化性大小顺序是MnO4->Cl2>Fe3+>I2,还原性大小顺序是I->Fe2+>Cl->Mn2+,为了氧化I?-而不使Fe2+被氧化,则应该选取铁盐,
故选D.
本题解析:
本题难度:简单
4、选择题 (B类)对于反应2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O,若有0.1molKMnO4参加反应,下列说法中正确的是( )
A.还原剂是KMnO4
B.生成Cl25.6L
C.参加反应的HCl为16mol
D.其转移电子为0.5mol
参考答案:A.该反应中高锰酸钾中的锰元素化合价降低,所以高锰酸钾是氧化剂,故A错误;
B.根据反应方程式知,若有0.1molKMnO4?参加反应,应有0.25mol氯气生成,温度和压强未知,所以无法计算其体积,故B错误;
C.由方程式可知,若有0.1molKMnO4?参加反应,应有0.8molHCl参加反应,故C错误;
D.转移电子的物质的量为0.1mol×(7-2)=0.5mol,故D正确;
故选D.
本题解析:
本题难度:简单
5、选择题 分类法是学习和研究化学的一种常用的科学方法.下列分类合理的是( )
①Fe203、Ca0、C02都是碱性氧化物
②根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应
③根据元素原子最外层电子数的多少将元素分为金属元素和非金属元素
④洁净的空气、纯净的盐酸都是混合物
⑤根据分散系的稳定性将分散系分为胶体、溶液和浊液.
A.只有②④
B.只有①③⑤
C.只有①②④
D.只有②③⑤
参考答案:①依据碱性氧化物概念分析,Fe203、Ca0都是碱性氧化物,C02是酸性氧化物,故①错误;
②氧化还原反应的特征是元素化合价变化,实质是电子转移,可以依据是否有电子转移把反应分为氧化还原反应和非氧化还原反应,故②正确;
③一般都是看在化学反应中,单质是失电子的,为金属元素;得电子的,为非金属元素,最外层电子数不能作为分类的依据,故③错误;
④空气和盐酸都是不同物质组成的混合物,故④正确;
⑤分散系分为胶体、溶液和浊液的依据是分散质的微粒直径大小进行分类,故⑤错误;
故选A.
本题解析:
本题难度:一般