微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 小明做实验时不小心沾了一些KMnO4,皮肤上的黑斑很久才能消除,如果用草酸的稀溶液洗涤马上可以复原,其离子方程式为:MnO4-+H2C2O4+H+→CO2↑+Mn2++□(未配平).关于此反应的叙述正确的是( )
A.该反应的氧化剂是H2C2O4
B.1molMnO4-在反应中失去5mol电子
C.该反应右框内的产物是OH-
D.配平该反应后,H+的计量数是6
参考答案:A、化合价降低的元素是锰元素,所在反应物KMnO4是氧化剂,故A错误;
B、锰元素化合价从+7价降低到+2价,元素得到电子,化合价降低数=得到电子的数目=5,即1molMnO4-在反应中得到5mol电子,故B错误;
C、根据电子守恒,该反应中锰元素化合价降低5价,两碳元素化合价共升高2价,所以反应转移电子数为10,所以可以得到:2MnO4-+5H2C2O4+H+→10CO2↑+2Mn2++□,根据电荷守恒、原子守恒,所以□中为8H2O,H+的计量数是6,故C错误;
D、根据原子守恒、电子守恒和电荷守恒来配平离子方程式为:2MnO4-+5H2C2O4+6H+═10CO2↑+2Mn2++8H2O,H+的计量数是6,故D正确.
故选D.
本题解析:
本题难度:一般
2、推断题 (16分)以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下:

(1)酸溶过程中Fe2O3与稀硫酸反应的化学方程式为 ;
“滤渣A”主要成份的化学式为 。
(2)还原过程中加入FeS2的目的是将溶液中的Fe3 +还原为Fe2 +,而本身被氧化为H2SO4,请完成该反应的离子方程式:FeS2 + 14Fe3 + + H2O="=" 15Fe2 + + SO42- + 。
(3)氧化过程中,O2、NaOH与Fe2+反应的离子方程式为 。
(4)为了确保铁红的质量,氧化过程需要调节溶液的pH的范围是 (几种离子沉淀的pH见下表);滤液B可以回收的物质有(写化学式) 。
沉淀物
| Fe(OH)3
| Al(OH)3
| Fe(OH)2
| Mg(OH)2
|
开始沉淀pH
| 2.7
| 3.8
| 7.6
| 9.4
|
完全沉淀pH
| 3.2
| 5.2
| 9.7
| 12.4
|
参考答案:(16分)
(1)(5分)Fe2O3 + 3H2SO4 ="=" Fe2(SO4) 3+ 3H2O(2分。化学式1分、配平1分)
SiO2(2分。多写FeS2不扣分,多写其它化学式0分)
(2)(3分)8 2 16H+(第空1分)
(3)(4分)4Fe2 + + O2 + 2H2O + 8OH-= 4Fe(OH)3↓ (化学式对2分、配平2分。或
Fe2++2OH-=Fe(OH)2↓(2分),4Fe(OH)2+O2+2H2O=4Fe(OH)3(2分)
(分两个方程写:第个方程式化学式对1分、配平1分)
(4)(5分)3.2~3.8(或之间的数据值,2分) Na2SO4、Al2(SO4)3、MgSO4(3分,多写H2SO4不扣分,多写其它0分)
本题解析:(1)氧化铁与稀硫酸反应生成硫酸铁和水,化学方程式为Fe2O3 + 3H2SO4 ="=" Fe2(SO4) 3+ 3H2O;硫酸渣中只有二氧化硅不与稀硫酸反应,所以“滤渣A”主要成份的化学式为SiO2;
(2)FeS2中的S元素的化合价是-1价,生成物中Fe的化合价是+2价,S的化合价是+6价,整体升高14价,而Fe3+的化合价降低1价,根据升降化合价总数相等,所以Fe3+的系数是14,则SO42-的系数是2,再根据元素守恒和电荷守恒判断生成物中还有氢离子,其系数为16,则水的系数是8;
(3)O2、NaOH与Fe2+反应生成氢氧化铁沉淀,离子方程式为4Fe2 + + O2 + 2H2O + 8OH-= 4Fe(OH)3↓;
(4)根据表中数据使铁离子完全沉淀,而其他离子不能沉淀,所以溶液的pH的范围是)3.2~3.8;滤液B中则含有其他离子的硫酸盐,如Na2SO4、Al2(SO4)3、MgSO4。
考点:考查对工艺流程的分析,物质的判断,化学方程式的配平
本题难度:困难
3、实验题 (12分)某学生为探究钠与CO2的反应,利用如下装置进行实验。(已知PdCl2能被CO还原得到黑色的Pd)。可供选择的药品有:CaCO3(块状)、Na2CO3(粉末)、盐酸、稀硫酸、钠。
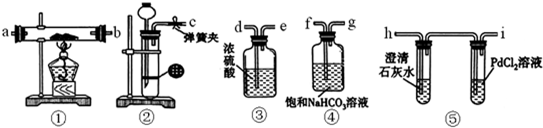
(1)请将上图各装置连接完整:②→ → →①→ 。(填装置序号)
(2)写出装置②中反应的离子方程式: 。
(3)检查装置气密性并装好药品后,当观察到 现象时再点燃酒精灯;装置④的作用是 。
(4)已知CO在潮湿环境中可将PdCl2还原为黑色粉末状的钯(Pd),写出该反应的化学方程式 。
(5)实验过程中CO2足量,装置⑤PdCl2溶液中观察到有黑色沉淀,装置①中反应后固体成分只有一种,且向固体中加入稀盐酸产生能使澄清石灰水变浑浊的气体。据此现象写出Na与CO2反应的化学方程式: 。
参考答案:(1)④③⑤(2分) (2)CaCO3+2H+=Ca2++CO2↑+H2O
(3)装置⑤中澄清石灰水变浑浊;吸收挥发出来的HCl
(4)PdCl2+CO+H2O=Pd+CO2+2HCl
(5)2Na+2CO2
本题解析:
本题难度:困难
4、选择题 M2O7X-与S2-在酸性溶液中反应如下:M2O7X-+3S2-+14H+=2M3++3S↓+7H2O,则M2O7X-中M的化合价是
A.+2
B.+3
C.+4
D.+6
参考答案:D
本题解析:略
本题难度:一般
5、选择题 下列材料属于复合材料的是
A.合金
B.玻璃钢
C.隔热陶瓷瓦
D.耐高温结构陶瓷
参考答案:B、C
本题解析:合金是由两种或两种以上的金属或非金属融合而成的具有金属特性的物质,不属于复合材料。耐高温结构陶瓷多是单一材料,如氮化硅结构陶瓷等。玻璃钢是玻璃纤维和合成树脂形成的复合材料。隔热陶瓷瓦是由纤维(如碳纤维)和陶瓷形成的复合材料
本题难度:简单