微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 从淡化海水中提取溴的流程如图所示,下列有关说法错误的是

A.X为SO2气体,也可将SO2换成Na2SO3
B.设备Y为蒸馏塔
C.在提取溴的过程中一定有Br-被氧化
D.工业上每获得1 mol Br2,需要消耗Cl2的体积最多为44.8 L(标准状况下)
参考答案:D
本题解析:选项A,Br2也能被Na2SO3溶液吸收形成Br-。选项B,Br-先被Cl2氧化为Br2,然后经蒸馏得到Br2蒸气。选项C,海水中Br-被氧化为Br2以及吸收塔内都发生了Br-被氧化的反应。选项D,根据选项C分析可知,两步反应都发生Cl2氧化Br-的反应,考虑到氯气部分溶于水等因素,实际生产中工业上每获得1 mol Br2,需要消耗Cl2的体积大于44.8 L(标准状况下)。
本题难度:一般
2、选择题 已知FeS2与某浓度的HNO3反应时生成Fe(NO3) 3、H2SO4和某单一的还原产物,若FeS2和参与反应的HNO3的物质的量之比为1:8,则该反应的还原产物是
A.NO2
B.NO
C.N2O
D.NH4NO3
参考答案:B
本题解析:这是一道有关氧化还原反应的问题,应遵循电子守恒,在反应中,硫化亚铁是还原剂,假设硫化亚铁是1mol,那么铁失去1 mol的电子,而2 mol硫由负一价升高到正六价,失去14mol的电子,总共失去15 mol的电子,这些电子都是由硝酸得到的,8 mol的硝酸中有3 mol是用来结合三价铁离子的,还剩余5mol,总共得到15 mol的电子,那么每摩尔的硝酸要得到3mol的电子,化合价就会从正五价变成正二价。因此选B。
本题难度:一般
3、选择题 已知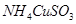 与足量的10mol/L硫酸液混合微热,产生下列现象:①有红色金属生成?②产生刺激性气味的气体 ③溶液呈现蓝色。据此判断下列说法正确的是
与足量的10mol/L硫酸液混合微热,产生下列现象:①有红色金属生成?②产生刺激性气味的气体 ③溶液呈现蓝色。据此判断下列说法正确的是
A.反应中硫酸作氧化剂
B.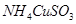 中硫元素被氧化
中硫元素被氧化
C.刺激性气味的气体是氨气
D.1mol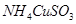 完全反应转移0.5mol电子
完全反应转移0.5mol电子
参考答案:D
本题解析:A、硫酸起酸性作用,错误;B、硫元素没有发生氧化还原反应,错误;C、刺激性气味的气体是二氧化硫,错误。D、铜元素发生歧化反应,正确。
本题难度:一般
4、实验题 用图所示的装置制取氢气,在塑料隔板上放粗锌粒.漏斗和带支管的试管中装有稀硫酸,若打开弹簧夹。则酸液由漏斗流下,试管中液面上升与锌粒接触,发生反应,产生的氢气由支管导出;若关闭弹簧夹,则试管中液面下降,漏斗中液面上升,酸液与锌粒脱离接触,反应自行停止。需要时再打开弹簧夹,又可以使氢气发生,这是一种仅适用于室温下随制随停的气体发生装置。
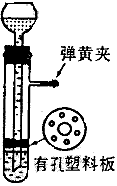
回答下列问题:
(1)为什么关闭弹簧夹时试管中液面会下降?
___ ___________________________________________。
(2)这种制气装置在加入反应物前,怎样检查装置的气密性?
______________________________________________。
(3)从下面三个反应中选择可以用这种随制随停的制气装置制取的气体,填写下表中的空白。
①大理石与盐酸反应制取CO2
②硫化亚铁与盐酸反应制取硫化氢
③用二氧化锰催化分解过氧化氢制氧气
?(4)食盐跟浓硫酸反应制取氯化氢不能用这种装置,试说明理由。
_________________________________________________
参考答案:(1)关闭弹簧夹,反应产生的气体使试管内液面上的压力增加,所以液面下降。
(2)塞紧橡皮塞,夹紧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于试管内的水面,停止加水后,漏斗中与试管中的液面差保持不再变化,说明装置不漏气
(3)
气体名称
离子方程式
收集方法
检验方法
二氧化碳
CaCO3+2H+==Ca2++CO2↑+H2O向上排空气法通入澄清石灰水
硫化氢
FeS+2H+==Fe2++H2S↑ 向上排空气法有臭鸡蛋味(或通入硫酸铜溶液)(4)因为此反应需要加热且食盐是粉末状
本题解析:
本题难度:困难
5、计算题 已知:化学反应3Ag+ 4HNO3 (稀)= 3AgNO3+ NO↑+ 2H2O?
(1)该反应的离子方程式为:_________________________________? ____
(2)当有32.4克银溶解时,反应生成的NO在标况下的体积是多少?
(3)当有0.2mol银溶解时,有多少克HNO3被还原?
参考答案:(1)3Ag+4H++NO3-=3Ag++NO↑+2H2O
(2)2.24L?(3)4.2g
本题解析:考查根据方程式进行的有关计算。
(1)根据化学方程式可知,该反应的离子方程式为3Ag+4H++NO3-=3Ag++NO↑+2H2O。
(2)32.4g银是324g÷108g.mol=0.3mol,所以根据方程式可知生成NO是0.1mol,标准状况下的体积是2.24L。
(3)0.2mol银失去0.2mol电子。稀释在反应中得到3个电子,所以被还原的硝酸是 。
。
本题难度:一般