微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 我国西部地区拥有非常丰富的盐湖资源,对盐湖矿产资源的综合开发利用是西部大开发的重要课题之一。某校实验小组拟采用盐湖苦卤(富含K+、Mg2+、Br-、SO42-、Cl-等)为原料,制取较纯净的无水MgCl2、KCl晶体及液溴(Br2),他们设计了如下实验方案:
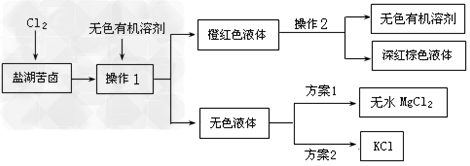
提供的相关信息如下
①KCl,MgCl2,K2SO4,MgSO4在水中的溶解度随温度变化的关系如下图a所示
②温度和压强P(HCl)g对MgCl2·6H2O晶体热分解产物的影响如下图b所示
③Ksp[Mg(OH)2]=1.6×10-11
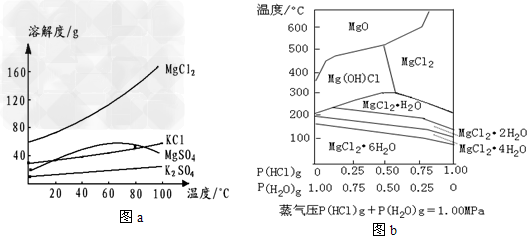
HCl-H2O气氛下的MgCl2-MgO分布图
请根据以上信息回答下列问题:
(1)操作1中的无色有机溶剂可以选择________________。
A.四氯化碳?B.乙醇?C.苯?D.己烯
(2)操作2的名称为__________。
(3)在方案1中甲同学采用了以下实验流程得到了无水MgCl2
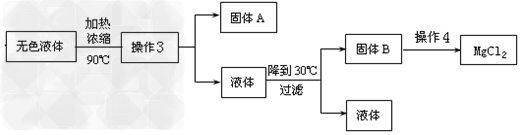
①操作3所得固体A是___________(填化学式);
②写出操作4中,P(HCl)g=0.25MPa,温度从300℃升高到550℃时反应的化学方程式______________________;
③实际生产中,将MgCl2·6H2O晶体加热失水得到无水MgCl2的适宜条件是____________。
(4)乙同学在方案2中,对上述操作1后无色溶液进行除杂提纯,得到了KCl晶体,其实验步骤如下:

①假设试剂B是一种正盐,则B的化学式为_________________;
②操作⑤中除了用到铁架台(带铁圈)、蒸发皿外,还用到哪些玻璃仪器??__________;
③实验过程中,为确保Mg2+完全除尽,应调节溶液的pH≥_________(结果保留1位小数,且假设离子浓度小于10-6mol/L可视作已被完全除尽,lg2=0.3)。
参考答案:(1)AC
(2)蒸馏?
(3)①?K2SO4;②Mg(OH)Cl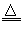 MgO?+?HCl↑;③a.通入HCl气体,增大P(HCl),b.加热控制适宜温度,并以300℃~500℃为宜
MgO?+?HCl↑;③a.通入HCl气体,增大P(HCl),b.加热控制适宜温度,并以300℃~500℃为宜
(4)①K2CO3;②酒精灯、玻璃棒;③11.6
本题解析:
本题难度:一般
2、实验题 三草酸合铁酸钾晶体(K3[Fe(C2O4)3]·xH2O)是一种光敏材料,在110℃可完全失去结晶水。为测定该晶体中铁的含量和结晶水的含量,某实验小组做了如下实验:
(1)?铁含量的测定
步骤一:称量5.00g三草酸合铁酸钾晶体,配制成250ml溶液。
步骤二:取所配溶液25.00ml于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部氧化成二氧化碳,同时,MnO4-被还原成Mn2+。向反应后的溶液中计入一小匙锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性。
步骤三:用0.010mol/L KMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02ml滴定中MnO4-,被还原成Mn2+ 。
重复步骤二、步骤三操作,滴定消耗0.010mol/L KMnO4溶液19.98ml
请回答下列问题:
①?配制三草酸合铁酸钾溶液的操作步骤依次是:称量、_______、转移、洗涤并转移、________摇匀。
②?加入锌粉的目的是________。
③?写出步骤三中发生反应的离子方程式________。
④?实验测得该晶体中铁的质量分数为__________。在步骤二中,若加入的KMnO4的溶液的量不够,则测得的铁含量__________。(选填“偏低”“偏高”“不变”)
(2)?结晶水的测定
将坩埚洗净,烘干至恒重,记录质量;在坩埚中加入研细的三草酸合铁酸钾晶体,称量并记录质 量;加热至110℃,恒温一段时间,至于空气中冷却,称量并记录质量;计算结晶水含量。请纠正实验过程中的两处错误;_________;_________。
量;加热至110℃,恒温一段时间,至于空气中冷却,称量并记录质量;计算结晶水含量。请纠正实验过程中的两处错误;_________;_________。
参考答案:

本题解析:略
本题难度:一般
3、推断题 (13分)硫代硫酸钠(Na2S2O3)俗称海波,它可看成是用一个S原子取代了Na2SO4中的一个O原子而形成的。某校化学研究性学习小组用类比学习思想,并通过实验探究Na2S2O3的化学性质。
【提出问题】Na2S2O3与Na2SO4结构相似,化学性质是否也相似呢?
【实验探究】取适量Na2S2O3晶体,溶于水制成Na2S2O3溶液,进行如表所示的探究,完成表中有关内容。
实验操作
| 实验现象
| 现象解释(用离子方程式表示)
|
探究①A.?
B.向pH=2的硫酸中滴加Na2S2O3溶液
| a.溶液pH=8
b.?
| i.?
ii. S2O32-+2H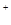 =S↓ +SO2↑ +H2O =S↓ +SO2↑ +H2O
|
探究②C.向新制氯水(pH<2)中滴加少量Na2S2O3溶液
| c.氯水颜色变浅
| iii.?
|
【实验结论】探究①?探究②?。
根据探究①和探究②的结论,Na2S2O3和Na2SO4化学性质?。
【问题讨论】
(1)甲同学向探究②反应后的溶液中滴加AgNO3溶液,出现白色沉淀,据此甲同学认为氯水可将Na2S2O3氧化。你认为此方案是否正确并说明理由:?。
(2)请你重新设计一个实验方案,证明Na2S2O3能被氯水氧化。你设计的方案是?。
参考答案:A.用玻璃棒蘸取Na2S2O3溶液点在pH试纸上,并与标准比色卡对照(1分)
i. S2O32-+H2O HS2O3-+OH-(2分)
HS2O3-+OH-(2分)
B. 有淡黄色沉淀(1分),有无色刺液性气味气体产生(1分)
iii. S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+(2分)
探究①:Na2S2O3溶液呈碱性(1分),能与强酸反应(1分)。
探究②:Na2S2O3具有还原性(1分),不相似(1分)。
【问题与讨论】(1)不正确,因为氯水中含有Cl-(1分)。
(2)取少量探究②反应后的溶液,向其中滴入BaCl2溶液,若有白色沉淀,则说明Na2S2O3被氯水氧化。(1分)
本题解析:A.根据实验现象可知,该步操作是测定溶液pH值的,因此正确的操作应该是用玻璃棒蘸取Na2S2O3溶液点在pH试纸上,并与标准比色卡对照。
i.溶液显碱性,说明酸根水解,离子方程式为S2O32-+H2O HS2O3-+OH-。
HS2O3-+OH-。
B.根据反应的生成物有单质硫和 二氧化硫生成可知,实验现象为有淡黄色沉淀,有无色刺液性气味气体产生。
iii.氯水颜色变浅说明发生了氧化还原反应,即硫代硫酸钠被氧化,则反应的离子方程式为S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+。
根据实验操作以及实验现象可知探究①是探究Na2S2O3溶液呈碱性,能与强酸反应。探究②是探究Na2S2O3具有还原性。由于硫酸钠不能与强酸反应,也没有还原性,所以二者的性质不相似。
【问题与讨论】(1)因为氯水中含有Cl-也能与硝酸银溶液反应产生白色沉淀,因此结论是不正确的。
(2)由于氧化产物是硫酸钠,因此可以通过验证硫酸根的生成即可,则实验操作为取少量探究②反应后的溶液,向其中滴入BaCl2溶液,若有白色沉淀,则说明Na2S2O3被氯水氧化。
本题难度:一般
4、选择题 下列实验不能达到预期目的的是?(?)
序号
| 实验操作?
| 实验目的
|
A
| 浓、稀HNO3分别与Cu反应
| 比较浓、稀HNO3的氧化性强弱
|
B
| MgCl2、AlCl3浓液中分别通入NH3
| 比较镁、铝的金属性强弱
|
C
| 测定等浓度的Na3PO4、Na2SO4两溶液的PH
| 比较磷、硫的非金属性强弱
|
D
| 用等浓度的盐酸、碳酸氢钠两溶液混合反应
| 比较盐酸、碳酸的酸性强弱
参考答案:B
本题解析:本题考查实验分析能力;HNO3浓度不同,与铜反应的速率不同,产物不同,浓硝酸的氧化性大于稀硝酸,A可达到实验目的;MgCl2、AlCl3浓液中分别通入NH3,都会产生白色沉淀,氢氧化铝不溶于弱碱,不能比较其金属性强弱;B不能达到实验目的;Na3PO4是强碱弱酸盐,Na2SO4是强酸强碱盐,等浓度的两溶液,Na3PO4的pH大于Na2SO4的pH,可知P的非金属性<S,C可达到实验目的;用等浓度的盐酸、碳酸氢钠两溶液混合,可生成无色气体CO2,说明了强酸HCl制弱酸H2CO3,D可达到实验目的。
本题难度:一般
5、选择题
A.上述实验证明了氧化性:Fe3+>Fe2+>Cu2+
B.上述实验证明了Fe2+既有氧化性又有还原性
C.实验①、③中的化学反应都是置换反应
D.向三个实验后的溶液中加入足量NaOH溶液,最终都有Fe(OH)3生成
参考答案:D
本题解析:略
本题难度:简单
|