微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 新型材料纳米α-Fe粉具有超强的磁性能,可用作高密度磁记录的介质以及高效催化剂等。在不同温度下,α-Fe粉与蒸气反应的固体产物不同:温度低于570℃时,生成FeO,高于570℃时,生成Fe3O4。
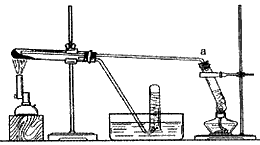
(1)甲同学用下图所示装置进行α-Fe粉与水蒸气的反应。

证明实验中有氢气产生的现象是______________________。
(2)乙同学用下图所示装置进行α-Fe粉与水蒸气的反应并验证产物。
①试管a中的物质是____________。
②乙同学为探究实验结束后试管内的固体物质成分,进行了下列实验

实验现象不能确定是否存在Fe3O4,主要原因是________________(用离子方程式表示)
③乙同学称取5.60gFe粉,用上图装置反应一段时候后,停止加热。将试管内的固体物质在干燥器中冷却后,称得质量为6.88g。然后将冷却后的固体物质与足量FeCl3溶液充分反应,测定消耗FeCl3的物质的量,最终确定产物的成分。若此装置中Fe粉与水蒸气反应的产物为Fe3O4,则消耗FeCl3的物质的量应为
_________mol。
参考答案:(1)有大量肥皂泡生成,部分肥皂泡浮在空中,点燃肥皂泡发生轻微爆炸
(2)①水;②溶液没有出现血红色;2Fe3++Fe=3Fe2+;③0.08
本题解析:
本题难度:困难
2、实验题 (10分)工业上利用含锰废水(主要含MnSO4、H2SO4、和铁、铝、铜等金属的硫酸盐)制取碳酸锰(MnCO3)。步骤如下:
Ⅰ.氧化:向废水中加入氧化剂;?
Ⅱ.中和:控制温度在40~50 ℃,加入氨水,过滤;?
Ⅲ.除重金属:向滤液中加入BaS溶液,除去Cu2+等重金属,过滤,得MnSO4溶液;
Ⅳ.制固体MnSO4:从MnSO4溶液得其固体;
Ⅴ.制MnCO3:用水溶解MnSO4固体,加入NH4HCO3溶液,得MnCO3沉淀粗品;
Ⅵ.洗涤:用水洗涤MnCO3粗品至无SO42-,获得高纯MnCO3。
回答下列问题:
(1)Ⅰ中,下列氧化剂均能把Fe2+氧化为Fe3+,最佳的试剂是_____。
a.浓HNO3? b.MnO2?c.K2Cr2O7?
(2)Ⅱ中,氨水除中和酸外,同时沉淀Fe3+、Al3+等,沉淀Al3+的离子方程式是:
______________________________________________________。
(3)Ⅳ中,溶液需浓缩、结晶、_______(填一种分离操作的名称),得MnSO4固体。
(4)Ⅴ中生成MnCO3沉淀的离子方程式是:
______________________________________________________。
(5)由MnCO3可制得重要的催化剂MnO2,MnCO3 → MnO2 + CO。
现加热分解 460.0 kg的MnCO3,得到332.0 kg产品,若产品中杂质只有MnO,则该产品中MnO2的质量是?kg。(摩尔质量/g·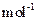 :MnCO3 115? MnO2 87? MnO 71)
:MnCO3 115? MnO2 87? MnO 71)
参考答案:(10分)(每空2分)
(1) b
(2) ?Al3+ + 3NH3·H2O ="=" Al(OH)3 ↓ + 3NH4+
(3)过滤
(4)Mn2+ + 2 HCO3- ="=" MnCO3 ↓ + H2O + CO2 ↑
(5)261.0?
本题解析:(1)只能用双氧水来氧化,另外两种物质虽能氧化亚铁离子,但是又引入了新的杂质。
(5)MnCO3 → MnO2 + CO。MnCO3的物质的量为4000mol,如果产物全是MnO2,产物质量应为348.0Kg,因为有杂质MnO,产物质量为332.0Kg,MnO的物质的量为:
 ?。依据质量守恒,MnO2物质的量为3000mol,质量为261.0Kg。
?。依据质量守恒,MnO2物质的量为3000mol,质量为261.0Kg。
本题难度:一般
3、填空题 二氯化二硫(S2Cl2)在工业上用于橡胶的硫化.为了在实验室合成S2Cl2,某化学研究性小组查阅了有关资料,得到如下信息:
①在110℃-140℃时,将干燥的氯气与硫反应可得到S2Cl2的粗产品.
②有关物质的部分性质如下表:
| 物质 | 熔点/℃ | 沸点/℃ | 化学性质
S
112.8
44.6
略
S2Cl2
-77
137 | S2Cl2、遇水生成HCl、SO2、S且温度过高容易分解(300度以上完全分解)
SCl2
-121
59.6(分解)
|
设计实验装置如下图:
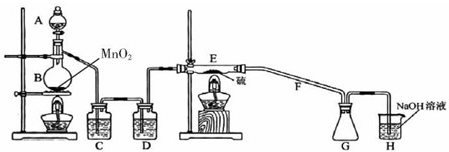
(1)仪器A的名称分别为______.
B中发生反应的离子方程式为______.
C中的试剂名称是______;仪器D的作用是______.
(2)上图中装置不够完善,请你提出改进意见______;
(3)利用改进后的正确装置进行实验,请回答下列问题
①E中反应的化学方程式为______.
②如果在加热E时温度过高,对实验结果的影响是______.
③S2Cl2粗品中可能混有的杂质是SCl2、Cl2、S,为了提高S2Cl2的纯度,关键的操作是控制好温度和______.
参考答案:(1)A、B分别是分液漏斗和蒸馏烧瓶;B中发生反应的离子方程式是浓盐酸与二氧化锰制取氯气的离子方程式:MnO2+4H++2Cl-△.Mn2++Cl2↑+2H2O;氯气制取过程中的产生杂质HCl、H2O,因此先用饱和食盐水除去氯气中的HCl,再用浓硫酸进行干燥即可得纯净干燥的氯气;
故答案:分液漏斗;MnO2+4H++2Cl-△.Mn2++Cl2↑+2H2O;饱和食盐水;除去氯气中少量的水蒸气;
(2)因S2Cl2遇水生成HCl、SO2、S,在G中生成的S2Cl2易与H中扩散过来的水蒸气反应而变质,故应在G和H之间增加干燥装置;
故答案为:在G和H之间增加干燥装置;
(3)①E中反应的化学方程式由信息可得:2S+C12△.S2C12
故答案为:2S+C12△.S2C12
②由表中信息S2Cl2在300℃以上完全分解,所以加热E时温度过高会导致产率降低,在F中可能有硫析出;
故答案为:因副反应产率降低或S2Cl2因温度过高会分解;
(5)根据信息,温度控制不当,则会生成SCl2,还有未反应的氯气以及蒸发出的硫.所以关键的操作是控制好温度和氯气的气流速度要恰当,应控制浓盐的滴速不要过快;
故答案为:控制浓盐酸的滴速不要过快.
本题解析:
本题难度:一般
4、实验题 (12分)某实验小组利用如下图所示装置完成有关实验。
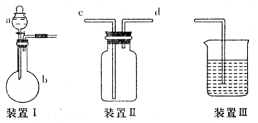
(1) 有关 气体的制取、收集、尾气处理问题
气体的制取、收集、尾气处理问题
①仪器a的名称:__________,若装置I用于制取SO2,则反应的化学方程式为: __________
装置III可用于气体的吸收,若用于吸收Cl2,则IH中所盛放液体为____________________
A.水
B.浓硫酸
C.NaOH溶液
D.饱和NaCl溶液