微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 新型材料纳米α-Fe粉具有超强的磁性能,可用作高密度磁记录的介质以及高效催化剂等。在不同温度下,α-Fe粉与蒸气反应的固体产物不同:温度低于570℃时,生成FeO,高于570℃时,生成Fe3O4。
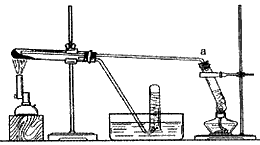
(1)甲同学用下图所示装置进行α-Fe粉与水蒸气的反应。

证明实验中有氢气产生的现象是______________________。
(2)乙同学用下图所示装置进行α-Fe粉与水蒸气的反应并验证产物。
①试管a中的物质是____________。
②乙同学为探究实验结束后试管内的固体物质成分,进行了下列实验

实验现象不能确定是否存在Fe3O4,主要原因是________________(用离子方程式表示)
③乙同学称取5.60gFe粉,用上图装置反应一段时候后,停止加热。将试管内的固体物质在干燥器中冷却后,称得质量为6.88g。然后将冷却后的固体物质与足量FeCl3溶液充分反应,测定消耗FeCl3的物质的量,最终确定产物的成分。若此装置中Fe粉与水蒸气反应的产物为Fe3O4,则消耗FeCl3的物质的量应为
_________mol。
2、实验题 (10分)工业上利用含锰废水(主要含MnSO4、H2SO4、和铁、铝、铜等金属的硫酸盐)制取碳酸锰(MnCO3)。步骤如下:
Ⅰ.氧化:向废水中加入氧化剂;?
Ⅱ.中和:控制温度在40~50 ℃,加入氨水,过滤;?
Ⅲ.除重金属:向滤液中加入BaS溶液,除去Cu2+等重金属,过滤,得MnSO4溶液;
Ⅳ.制固体MnSO4:从MnSO4溶液得其固体;
Ⅴ.制MnCO3:用水溶解MnSO4固体,加入NH4HCO3溶液,得MnCO3沉淀粗品;
Ⅵ.洗涤:用水洗涤MnCO3粗品至无SO42-,获得高纯MnCO3。
回答下列问题:
(1)Ⅰ中,下列氧化剂均能把Fe2+氧化为Fe3+,最佳的试剂是_____。
a.浓HNO3? b.MnO2?c.K2Cr2O7?
(2)Ⅱ中,氨水除中和酸外,同时沉淀Fe3+、Al3+等,沉淀Al3+的离子方程式是:
______________________________________________________。
(3)Ⅳ中,溶液需浓缩、结晶、_______(填一种分离操作的名称),得MnSO4固体。
(4)Ⅴ中生成MnCO3沉淀的离子方程式是:
______________________________________________________。
(5)由MnCO3可制得重要的催化剂MnO2,MnCO3 → MnO2 + CO。
现加热分解 460.0 kg的MnCO3,得到332.0 kg产品,若产品中杂质只有MnO,则该产品中MnO2的质量是?kg。(摩尔质量/g·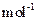 :MnCO3 115? MnO2 87? MnO 71)
:MnCO3 115? MnO2 87? MnO 71)
3、填空题 二氯化二硫(S2Cl2)在工业上用于橡胶的硫化.为了在实验室合成S2Cl2,某化学研究性小组查阅了有关资料,得到如下信息:
①在110℃-140℃时,将干燥的氯气与硫反应可得到S2Cl2的粗产品.
②有关物质的部分性质如下表:
| 物质 | 熔点/℃ | 沸点/℃ | 化学性质
S
112.8
44.6
略
S2Cl2
-77
137 | S2Cl2、遇水生成HCl、SO2、S且温度过高容易分解(300度以上完全分解)
SCl2
-121
59.6(分解)
|
设计实验装置如下图:
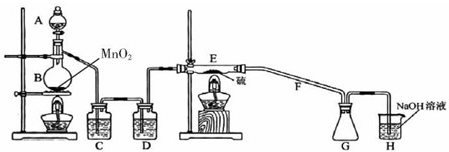
(1)仪器A的名称分别为______.
B中发生反应的离子方程式为______.
C中的试剂名称是______;仪器D的作用是______.
(2)上图中装置不够完善,请你提出改进意见______;
(3)利用改进后的正确装置进行实验,请回答下列问题
①E中反应的化学方程式为______.
②如果在加热E时温度过高,对实验结果的影响是______.
③S2Cl2粗品中可能混有的杂质是SCl2、Cl2、S,为了提高S2Cl2的纯度,关键的操作是控制好温度和______.
4、实验题 (12分)某实验小组利用如下图所示装置完成有关实验。
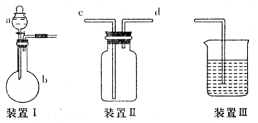
(1) 有关 气体的制取、收集、尾气处理问题
气体的制取、收集、尾气处理问题
①仪器a的名称:__________,若装置I用于制取SO2,则反应的化学方程式为: __________
装置III可用于气体的吸收,若用于吸收Cl2,则IH中所盛放液体为____________________
A.水
B.浓硫酸
C.NaOH溶液
D.饱和NaCl溶液