微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 要使含有Ba2+、Al3+、Cu2+、Mg2+、Ag+等离子的溶液中的各离子逐一形成沉淀析出,下列所选择的试剂及加入试剂的顺序正确的是
[? ]
A.H2SO4-HCl-H2S-NaOH-CO2
B.HCl-H2SO4-Na2S-NaOH-CO2
C.NaCl-Na2SO4-Na2S-NaOH-CH3COOH
D.Na2S-Na2SO4-NaCl-NaOH-HCl
参考答案:B
本题解析:
本题难度:简单
2、填空题 Ⅰ铁盐、亚铁盐是实验室常用的药品。
请根据题意,完成下列填空:
(1)向酸化的FeCl3溶液中逐滴加入KI溶液,溶液变成棕褐色。该反应的离子方程式为?。
(2)向酸化的FeSO4溶液中加几滴硫氰化钾溶液,没有什么明显变化,再滴加双氧水,溶液变红色。继续滴加双氧水,红色逐渐褪去,且有气泡产生。
写出上述变化中,有关反应的离子方程式:
①?
②Fe3++3SCN-=Fe(SCN)3
③11H2O2+2SCN-=2SO42-+2CO2↑+N2↑+10H2O+2H+
若生成1mol N2,H2O2和SCN-的反应中转移电子的物质的量是?mol。
(3)根据以上实验,推断Fe2+、I-和SCN-的还原性由强到弱的顺序为?。
Ⅱ某课题组利用Fe粉和KNO3溶液反应,模拟地下水脱氮过程,探究脱氮原理。
(4)实验前:①先用0.1 mol·L-1H2SO4洗涤Fe粉,其目的是?,然后用蒸馏水洗涤至中性;②将KNO3溶液的pH调至2.5;③为防止空气中的O2对脱氮的影响,应向KNO3溶液通入?(写化学式)。
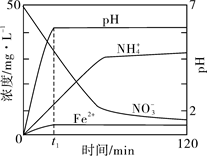
(5)如图表示足量Fe粉还原上述KNO3溶液过程中,测出的溶液中相关离子浓度、pH 随时间的变化关系(部分副反应产物曲线略去)。请根据图中信息写出t1时刻前该反应生成的阳离子分别是?、?。t1时刻后,该反应仍在进行,溶液中NH4+的浓度在增大,Fe2+的浓度却没有增大,可能的原因是?。
参考答案:(15分)
Ⅰ.(1)2Fe3++2I-=2Fe2+ +I2 ?(2分);
(2)2Fe2+ +H2O2+2H+= 2Fe3+ +2H2O (2分);22(2分);
(3)I->Fe2+>SCN- ?(2分)
Ⅱ.(4)除去Fe粉表面的铁锈(Fe2O3)等杂质 (2分);N2 (1分)
(5)Fe2+、NH4+?(各1分,共2分);
溶液的pH增大,Fe2+形成了Fe(OH)2或与溶液中OH—结合(2分)
本题解析:
(1)Fe3+具有氧化性,I-具有还原性,二者发生氧化还原反应生成Fe2+和I2。
(2)酸性条件下H2O2氧化Fe2+生成Fe3+和水。反应③中H2O2作氧化剂,S和N被氧化,每生成1molN2转移22mol电子。
(3)由2Fe3++2I-=2Fe2+ +I2 可知还原性I->Fe2+;由FeSO4溶液中加几滴硫氰化钾溶液,无明显变化可知还原性SCN-<Fe2+。
(4)用硫酸除去铁表面的铁锈。为防止氧气对脱氮的影响,可通入氮气。
(5)由图像可知t1时刻前生成的阳离子是Fe2+、NH4+。Fe与NO3-生成Fe2+和NH4+,Fe2+浓度没有增大可能的原因是溶液pH增大,Fe2+形成了Fe(OH)2。
本题难度:一般
3、选择题 下列反应的离子方程式书写正确的是
A.向KI溶液中通入少量氯气:Cl2+2I-=2Cl-+I2
B.向AlCl3溶液中滴入少量氨水:Al3++3OH-=Al(OH)3↓
C.向NaHCO3溶液中滴入少量稀硫酸:2H++CO32-=CO2↑+H2O
D.向Fe2(SO4)3溶液中加入少量铁粉:Fe3++Fe=2Fe2+
参考答案:A
本题解析:B氨水不能拆开。C,NaHCO3电离出HCO3-,D没配平。A正确。
本题难度:简单
4、选择题 下列物质中不是电解质的是
A.BaSO4
B.CH3COOH
C.漂白粉
D.Ca(OH)2
参考答案:C
本题解析:单质和混合物不是电解质,C错误。BaSO4是盐,醋酸是酸,Ca(OH)2为碱,都是电解质。
本题难度:困难
5、选择题 对某些离子的检验及结论一定正确的是?(?)
A.加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸沉淀不消失,则原溶液中一定有SO42-
B.通入Cl2后,溶液变为黄色,加入淀粉后溶液变蓝,则原溶液中一定有I-
C.加入碳酸钠溶液有白色沉淀生成,再加盐酸,沉淀消失,则原溶液中一定有Ba2+-
D.加入NaOH溶液并加热,产生使湿润的蓝色石蕊试纸变红的气体,则原溶液一定有NH4+
参考答案:B
本题解析:A中,可能有亚硫酸根,被氧化成硫酸根离子。B中正确。C中还可能有钙离子等。D使蓝色石蕊试纸变红,则气体呈酸性,一定不是氨气,所以原溶液中没有铵根离子。
点评:本题属于简单题,综合性不高,难度不大。
本题难度:一般