微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列离子方程式的书写正确的是
A.将明矾加入氢氧化钡溶液中使硫酸根离子沉淀完全:Al3+++Ba2++4OH-+BaSO4↓+2H2O
B.将过量二氧化硫通入澄清石灰水中:SO2+OH-
C.向氯化铝溶液中加入过量氨水:Al3++4NH3?H2O++2H2O
D.稀硝酸和过量铁屑反应:Fe+4H++NO3-Fe3++NO↑+2H2O
参考答案:B
本题解析:分析:A.硫酸根离子沉淀完全,二者以1:2反应,生成2molBaSO4;
B.反应生成亚硫酸根离子;
C.反应生成氢氧化铝和氯化铵;
D.过量铁,反应生成Fe2+.
解答:A.至SO42-恰好沉淀完全的离子反应为Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O,故A错误;
B.将过量二氧化硫通入澄清石灰水中的离子反应为SO2+OH-═HSO3-,故B正确;
C.向氯化铝溶液中加入过量氨水的离子反应为Al3++3NH3?H2O═Al(OH)3↓+3NH4+,故C错误;
D.稀硝酸和过量铁屑反应的离子反应为3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O,故D错误;
故选B.
点评:本题考查离子反应方程式的书写,明确发生的化学反应是解答本题的关键,注意与量有关的离子反应,选项D中Fe过量为易错点,题目难度中等.
本题难度:简单
2、选择题 甲、乙、丙、丁分别是Ca(OH)2溶液、KNO3溶液、Na2CO3溶液和盐酸中的一种.已知甲和丙可以反应,甲和丁也可以反应,则下列说法中正确的是( )
A.甲一定是Ca(OH)2溶液
B.乙一定是KNO3溶液
C.丙不可能是Na2CO3溶液
D.丁只能是盐酸
参考答案:A、甲、乙、丙、丁分别是Ca(OH)2溶液、KNO3溶液、Na2CO3溶液和盐酸中的一种.已知甲和丙可以反应,甲和丁也可以反应,甲可以是Ca(OH)2溶液、Na2CO3溶液和盐酸中的一种
,都可以和另外两种物质反应,故A错误;
B、甲、乙、丙、丁分别是Ca(OH)2溶液、KNO3溶液、Na2CO3溶液和盐酸中的一种.已知甲和丙可以反应,甲和丁也可以反应,甲可以是Ca(OH)2溶液、Na2CO3溶液和盐酸中的一种
,都可以和另外两种物质反应,退单乙一定为KNO3溶液,故B正确;
C、Ca(OH)2溶液、Na2CO3溶液和盐酸中,任意一种都会和另外两种物质反应所以,丙可能为Ca(OH)2溶液、Na2CO3溶液和盐酸中的任意一种,故C错误;
D、依据C分析,丁可以是Ca(OH)2溶液、Na2CO3溶液和盐酸中的任意一种,故D错误;
故选B.
本题解析:
本题难度:简单
3、选择题 BaCl2剧毒,致死量为0.3g,万一不慎误服,应大量吞服鸡蛋清及适量解毒剂,此解毒剂应是( )
A.AgNO3
B.CuSO4
C.Na2CO3
D.MgSO4
参考答案:A、氯化钡与硝酸银反应,生成不溶的氯化银,但生成的硝酸钡仍能电离出钡离子,且银离子属于重金属离子,不能达到目的,故A不正确.
B、硫酸铜能与氯化钡反应生成硫酸钡沉淀和氯化铜,铜离子属于重金属有毒离子,故B不正确;
C、氯化钡与碳酸钠反应生成了不溶的碳酸钡,但在胃中又会和胃酸作用重新生成氯化钡,不能解毒,故C不正确;
D、氯化钡和硫酸镁反应生成不溶的硫酸钡,不会再形成钡离子,而少量镁离子不影响健康,故D正确;
故选D.
本题解析:
本题难度:简单
4、选择题 类推思维是化学解题中常用的一种思维方法,下列有关离子方程式推理正确的是
[? ]
已知 类推
A. 

B. ?
? 
C.
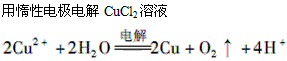
D.
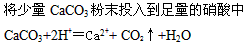
参考答案:D
本题解析:
本题难度:一般
5、填空题 (15分)某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随加入NaOH溶液的体积变化如图所示:

由此可知,(1)该溶液中肯定含有的阳离子是____________________,且各阳离子的物质的量之比为_____________;肯定不含有的阳离子是___________;检验可能含有的某种阳离子的常用实验方法是?;
(2)分别写出BC、CD段对应的离子方程式,并写出BC段参加反应的阳离子在实验室中常用的检验其存在的方法:BC:________________________________________;
检验:_____________________________________________;
CD:__________________________________________.
参考答案:⑴H+、Al3+、NH4+(2分);? 2∶1∶3(2分);Mg2+、Fe3+(2分);焰色反应(2分)。
⑵NH4++OH- NH3·H2O(或NH4++OH- =NH3↑+H2O)(2分);?取少量未知试液于试管中,滴加氢氧化钠溶液后加热,如果产生有刺激性气味的气体,且该气体能使湿润的红色石蕊试纸变蓝,则证明原待测液中有NH4+存在(或该气体遇到沾有浓盐酸的玻璃棒有白烟现象也能证明NH4+存在)(3分);
NH3·H2O(或NH4++OH- =NH3↑+H2O)(2分);?取少量未知试液于试管中,滴加氢氧化钠溶液后加热,如果产生有刺激性气味的气体,且该气体能使湿润的红色石蕊试纸变蓝,则证明原待测液中有NH4+存在(或该气体遇到沾有浓盐酸的玻璃棒有白烟现象也能证明NH4+存在)(3分);
Al(OH)3+OH- =AlO2-+2H2O(2分)
本题解析:(1)根据图像可知,最初没有沉淀生成,所以一定含有氢离子。当沉淀达到最大值时,继续加入氢氧化钠,沉淀不发生变化,说明还含有NH4+。根据沉淀溶解时消耗的氢氧化钠溶液体积和生成沉淀时消耗的氢氧化钠溶液体积可知,二者是1︰3,这么说沉淀只有氢氧化铝,没有氢氧化镁、氢氧化铁,所以一定含有Al3+,但没有Mg2+、Fe3+。根据溶液的电中性可知,一定还在SO42-,但钠离子并能确定,检验钠离子可以通过焰色反应确定。根据图像中消耗氢氧化钠溶液的体积,并结合反应式H++OH-=H2O、OH-+3OH-=Al(OH)3↓、NH4++OH-=NH3·H2O可知,H+、Al3+、NH4+的物质的量之比2∶1∶3。
(2)BC段是铵盐和强碱的反应,所以反应的化学方程式是NH4++OH- NH3·H2O。依据该实验原理可以检验NH4+,即取少量未知试液于试管中,滴加氢氧化钠溶液后加热,如果产生有刺激性气味的气体,且该气体能使湿润的红色石蕊试纸变蓝,则证明原待测液中有NH4+存在(或该气体遇到沾有浓盐酸的玻璃棒有白烟现象也能证明NH4+存在)。而CD段是溶解氢氧化铝的,所以反应的方程式是Al(OH)3+OH- =AlO2-+2H2O。4+的有关检验
NH3·H2O。依据该实验原理可以检验NH4+,即取少量未知试液于试管中,滴加氢氧化钠溶液后加热,如果产生有刺激性气味的气体,且该气体能使湿润的红色石蕊试纸变蓝,则证明原待测液中有NH4+存在(或该气体遇到沾有浓盐酸的玻璃棒有白烟现象也能证明NH4+存在)。而CD段是溶解氢氧化铝的,所以反应的方程式是Al(OH)3+OH- =AlO2-+2H2O。4+的有关检验
点评:进行物质的检验时,要依据物质的特殊性质和特征反应,选择适当的试剂和方法,准确观察反应中的明显现象,如颜色的变化、沉淀的生成和溶解、气体的产生和气味、火焰的颜色等,进行判断、推理、验证即可。
本题难度:困难