微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 有关阳离子交换膜电解饱和食盐水的(装置如图)说法正确的是
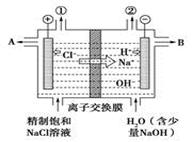
A.转移电子0.8 mol时产生氢气8.96 L
B.从出口B处导出的是氢氧化钠与氯化钠的混合溶液
C.装置中出口①处的气体能使湿润的淀粉碘化钾试纸变蓝
D.装置中的阳离子交换膜防止产生的氯气与氢氧化钠溶液反应
参考答案:B
本题解析:A、转移电子0.8 mol时产生氢气的量为0.8÷2×22.4="8.96" L(标准状况下),该题没有指明条件,错误;B、交换膜只能通过阳离子,氯离子不能通过,故出口B导出的是氢氧化钠溶液,错误;C、阳极氯离子失去电子,生成氯气,使湿润的淀粉碘化钾试纸变蓝,正确;D、电解时阳极产生的氯气与阴极产生的氢氧化钠通过交换膜隔离,防止反应,正确。
本题难度:简单
2、选择题 用Pt作电极,电解串联电路中分装在甲、乙两个烧杯中的200 mL0.3 mol/L NaCl的溶液和300 mL 0.2 mol/L的AgNO3溶液,当产生0.56L(标准状况)Cl2时停止电解,取出电极,将两烧杯溶液混合,混合液的pH为(假设:电解过程中电解产物不发生其他变化,混合后溶液的总体积为500ml。)?
A.1.4
B.5.6
C.7
D.12.6
参考答案:C
本题解析:因NaCl和AgNO3的物质的量相同,而串联电路中通过的电量相等,故可看作是电解NaNO3溶液,实质是电解了水,结果溶液呈中性。
本题难度:一般
3、选择题 下列关于实验现象的描述不正确的是?
[? ]
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B.用铜片做阳极,铁片做做阴极,电解氯化铜溶液,铁片表面出现一层铜
C.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快
参考答案:C
本题解析:
本题难度:一般
4、选择题 某同学组装了如图所示的电化学装置,电极Ⅰ为 Zn,电极Ⅱ为Cu,其他电极均为石墨,则下列说法正确的是
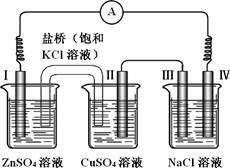
A.电流方向:电极Ⅳ →○→电极ⅠB.盐桥中的K+会移向ZnSO4溶液
C.处得到标况下气体2.24L,电极II上析出6.4g固体
D.NaCl溶液中,电极Ⅲ制得氯气,电极Ⅳ制得金属钠
参考答案:AC
本题解析:A、装置中左边两个烧杯构成为原电池,锌做原电池的负极,铜为原电池的正极,电流从铜电离流出经过电流表流向锌,所以选A;B、盐桥中钾离子向阴极负极移动,即流向硫酸铜溶液,不选B;C、第三个烧杯是电解氯化钠溶液,电极Ⅲ为电解池的阳极,产生氯气,当有2.24升氯气产生时有2.24/22.4摩尔氯气,有0.2摩尔电子转移,所以电极II上析出0.1摩尔铜,即析出6.4g固体,选C;D、氯化钠溶液中电解得到氯气和氢气和氢氧化钠,没有得到金属钠,不选D。
考点:原电池和电解池的原理的应用。
本题难度:一般
5、填空题 (10分)最新研究发现,用隔膜电解法处理高浓度乙醛废水具有工艺流程简单、电耗较低等优点,其原理是使乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸,总反应如下:2CH3CHO+H2O CH3CH2OH+CH3COOH
CH3CH2OH+CH3COOH
实验室中,以一定浓度的乙醛—Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置示意图如图所示。
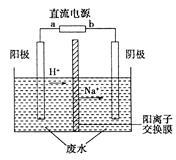
(1)若以锌锰碱性电池为直流电源,该电池总反应式为:Zn+2MnO2+2H2O===2MnO(OH)+Zn(OH)2。该电池的a电极的电极反应式为:_____________________________________________。
(2)电解过程中,两极除分别生成乙酸和乙醇外,均产生无色气体。电极反应式如下:
阳极:①4OH--4e-===O2↑+2H2O。
②_______________________________________________。
阴极:①__________________________________________。
②CH3CHO+2e-+2H2O===CH3CH2OH+2OH-。
(3)电解过程中,某时刻测定了阳极区溶液中各组分的物质的量,其中Na2SO4与CH3COOH的物质的量相同。此时刻下列关于阳极区溶液中各微粒浓度关系的说法正确的是 (填序号)。
a.c(Na+)=2c(CH3COOH)+2c(CH3COO-)
b.c(Na+)+c(H+)=c(SO42-)+c(CH3COO-)+c(OH-)
c.c(Na+)>c(CH3COOH)>c(CH3COO-)>c(OH-)
(4)已知:乙醛、乙醇的沸点分别为20.8 ℃、78.4 ℃。从电解后阴极区的溶液中分离出乙醇粗品的方法是 。
参考答案: (1) 2MnO2+2H2O+2e-=2MnO(OH)+2OH-。(2分)
(2)②CH3CHO-2e-+H2O=CH3COOH+2H+(2分)
①4H++4e-=2H2↑或2H++2e-=H2↑或4H2O+4e-=2H2↑+4OH-(2分)
(3)ac(2分) (5)分馏或蒸馏 (2分)
本题解析:(1)a电极与电解池的阳极相连,这说明a是正极。根据电池总反应式Zn+2MnO2+2H2O=2MnO(OH)+Zn(OH)2可正极是二氧化锰得到电子,则该电池的a电极的电极反应式为2MnO2+2H2O+2e-=2MnO(OH)+2OH-。
(2)电解池中阳极失去电子,除了氢氧根放电外,乙醛失去电子转化为乙酸,反应的电极反应式外CH3CHO-2e-+H2O=CH3COOH+2H+;阴极得到电子,除了乙醛得到电子转化为乙醇以外,溶液中的氢离子也得到电子转化为氢气,电极反应式为2H++2e-=H2↑。
(3)电解过程中,某时刻测定了阳极区溶液中各组分的物质的量,其中Na2SO4与CH3COOH的物质的量相同。此时刻下列关于阳极区溶液中各微粒浓度关系的说法正确的是 (填序号)。
a.根据物料守恒可知c(Na+)=2c(CH3COOH)+2c(CH3COO-),a正确;b.根据电荷守恒c(Na+)+c(H+)=2c(SO42-)+c(CH3COO-)+c(OH-)可知c(Na+)+c(H+)=c(SO42-)+c(CH3COO-)+c(OH-)是错误的,b不正确;c.醋酸是一元弱酸,电离常数小,则溶液中c(Na+)>c(CH3COOH)>c(CH3COO-)>c(OH-),c正确,答案选ac。
(4)已知:乙醛、乙醇的沸点分别为20.8 ℃、78.4 ℃,由于二者互溶,所以从电解后阴极区的溶液中分离出乙醇粗品的方法是蒸馏。
考点:考查电化学原理的应用、溶液中离子浓度比较以及物质的分离与提纯
本题难度:困难