微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 用黄铜矿(主要成分是CuFeS2)炼制粗铜主要有三个阶段:①将黄铜矿的精矿送入沸腾炉,在923~1073K条件下通空气进行焙烧,得到焙砂(主要成分是Cu2S、FeS)和废气;?②将焙砂送入反射炉进行高温熔炼制成冰铜(冰铜可看作由Cu2S和FeS组成);?③将冰铜送入转炉并在高温下吹入空气,在此阶段,Cu2S先变为Cu2O,Cu2O再与Cu2S反应生成Cu,FeS变为FeO.试回答下列问题:
(1)为防止污染环境,沸腾炉和转炉产生的废气用于制取______
(2)为加快黄铜矿的焙烧速率,可采取的措施有(写出两种)______
(3)写出Cu2O与Cu2S反应生成Cu的化学方程式______
(4)写山FeO与足量稀硝酸反应的离子方程式______
(5)从整个过程来看,CuFeS2最终变为Cu、FeO和SO2,则1mol?CuFeS2完全反应总共消耗标准状况下空气______L(空气中氧气所占的体积分数按20%计算).
参考答案:(1)沸腾炉和转炉产生的废气主要是二氧化硫,可以用来获得硫酸,故答案为:硫酸;
(2)增大固体接触面积,升高温度,增大空气流速即增大氧气浓度均能加快化学反应速率,故答案为:将黄铜矿粉碎,增大空气流速,升高温度等;
(3)Cu2O与Cu2S反应生成Cu和二氧化硫,化学方程式为:Cu2O+2Cu2S?高温?.?6Cu+SO2↑,故答案为:Cu2O+2Cu2S?高温?.?6Cu+SO2↑;
(4)氧化亚铁可以和硝酸反应体现了硝酸的酸性和氧化性,硝酸能将亚铁离子氧化为最高价三价铁离子,即3FeO+NO3-+10H+=3Fe3++NO↑+5H2O,
故答案为:3FeO+NO3-+10H+=3Fe3++NO↑+5H2O;
(5)从整个过程来看,CuFeS2最终变为Cu、FeO和SO2,即2CuFeS2+5O2=2Cu+4SO2+2FeO,则1molCuFeS2完全反应消耗氧气的物质的量是2.5mol,体积是2.5mol×22.4L/mol=56L,需要空气的体积是56L20%=280L.故答案为:280.
本题解析:
本题难度:一般
2、选择题 下列叙述正确的是
[? ]
A.Na2O2、Cl2、NO2均能与水发生氧化还原反应
B.在加热的条件下稀硝酸、浓硫酸均能将木炭氧化成二氧化碳
C.Cu、Fe、C分别在氧气中燃烧均只生成一种氧化物
D.NaHCO3、Na2CO3、(NH4)2CO3三种固体受热后均易分解生成气体
参考答案:A
本题解析:
本题难度:简单
3、选择题 混合下列各组物质使之充分反应,加热蒸干产物并在300℃灼烧至质量不变,最终残留固体为纯净物的是
[?]
A.向CuSO4溶液中加入一小块金属钠
B.在NaBr溶液中通入少量氯气
C.等物质的量的NaHCO3与Na2O2固体
D.等物质的量浓度、等体积的(NH4)2SO4与BaC12溶液
参考答案:D
本题解析:
本题难度:一般
4、简答题 三星堆遗址考古的重大发现,揭开了川西平原早期蜀国的面纱,将蜀国的历史推前了两千多年,填补了中国考古学、青铜文化、青铜艺术史上的诸多空白.而硫酸铜是湿法冶金应用极早的一种化工原料.铜不能与稀硫酸直接反应,本实验中将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图1、2所示)
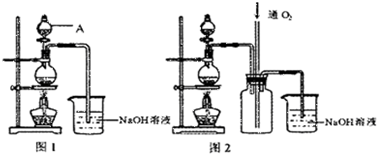
(1)图1烧瓶中发生反应的离子方程式为______;
(2)图2是图1的改进装置,其优点有______;
(3)为符合绿色化学的要求,某研究性学习小组进行如下设计:
第一组:以空气为氧化剂法
方案1:以空气为氧化剂.将铜粉在①坩埚中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应.
方案2:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应.向反应液中加FeSO4或Fe2(SO4)3,即发生反应.反应完全后向其中加物质甲调节pH到3~4,产生Fe(OH)3沉淀,过滤、蒸发、结晶,滤渣作催化剂循环使用.[已知Fe(OH)3和Cu(OH)2完全沉淀时的pH分别为:3.7、6.4.]请回答下列问题:
①方案2中甲物质是______(填字母序号).?a.CaO? b.CuCO3? c.CaCO3
第二组:过氧化氢为氧化剂法
将3.2g铜丝放到45mL?1.5mol?L-1的稀硫酸中,控温在50℃.加入18mL?10%的H2O2,反应0.5h后,升温到60℃,持续反应1h后,过滤、蒸发结晶、减压抽滤等,用少量95%的酒精淋洗后晾干,得到CuSO4?5H2O的质量为10.6g.?
?请回答下列问题:
②加热时温度不宜过高的原因是______,根据有关数据计算出制取CuSO4?5H2O的产率(实际产量与理论产量的百分比)=______.
参考答案:(1)将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,铜粉与稀硫酸不反应,铜与浓硝酸反应,Cu+4H++2NO3-═Cu2++2NO2↑+2H2O,随着反应的进行,浓硝酸变成稀硝酸,稀硝酸和铜反应生成硝酸铜和一氧化氮、水,3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,
故答案为:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O或3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;
(2)改进前,二氧化氮和水反应生成硝酸和一氧化氮,一氧化氮有毒且和水不反应,所以NO、NO2有毒气体不能被完全吸收,且二氧化氮和氢氧化钠反应后,导管内压强减小,易产生倒吸现象;改进后,通入氧气,氧气、一氧化氮、二氧化氮、水反应完全生成硝酸被氢氧化钠吸收;且中间储气瓶有缓冲作用,防止倒吸.
故答案为:可防止倒吸;NO、NO2有毒气体能被完全吸收;
(3)①除杂的原则,保证不引入杂质,加入氧化钙或碳酸钙都能引进新的杂质,故ac错误,故答案为:b;
?②过氧化氢不稳定,温度过高易分解生成水和氧气;设3.2g铜生成五水硫酸铜的质量为xg,根据铜原子守恒得铜和五水硫酸铜的关系式为:
Cu→CuSO4?5H2O?
64g? 250g
3.2g? xg
所以x=12.5
理论上生成CuSO4?5H2O?12.5克,故产率为10.6g12.5g×100%=84.8%,
故答案为:防止双氧水分解;84.8%.
本题解析:
本题难度:一般
5、选择题 元素及其化合物丰富了物质世界,下列说法正确的是( )
A.铜在冷的浓硫酸中会钝化,所以把铜放入冷的浓硫酸中无明显现象
B.NaOH溶液和AlCl3溶液相互滴加的现象不同
C.金属比非金属易失电子,所以金属可以置换非金属,而非金属不能置换金属
D.Al.Fe.Cu三者对应的氧化物均为碱性氧化物
参考答案:B
本题解析:
本题难度:简单