微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 取一定质量含Cu、Cu2O、和CuO的固体混合物,将其分成两等份并进行下列转化:
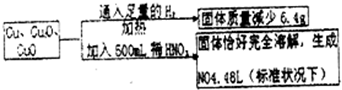
则转化过程中所加稀HNO3的物质的量浓度为( )
A.3.2mol/L
B.3.6mol/L
C.4.0mol/L
D.4.4mol/L
2、选择题 氢化亚铜(CuH)是一难溶物质,用CuSO4溶液和“另一种反应物”在40℃~50℃时反应可生成它。
CuH不稳定,易分解;CuH在氯气中能燃烧;CuH跟盐酸反应能产生气体。以下有关推断中不正确的是
[? ]
A.“另一种反应物”在反应中表现还原性
B.CuH在化学反应中既可做氧化剂也可做还原剂
C.CuH在氯气中燃烧的化学方程式为
D.CuH与盐酸反应生成的气体是H2
3、填空题 从回收的含铜电缆废料中提取铜时,假若设计如下两种方案,回答有关问题。

(1)两个方案中,符合当前生产中绿色化学理念的是方案________,理由是__________。
(2)方案乙中铜溶解生成蓝色溶液时发生反应的离子方程式为____________________________,若不考虑绿色化学要求,溶解铜生成硫酸铜时,还可将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使铜溶解完全,则理论上硫酸和硝酸的物质的量之比最佳为:____________。
(3)为了提高原料的利用率,最后一步所得浅绿色滤液通过蒸发浓缩、冷却结晶、过滤、洗涤、自然干燥可得到一种结晶水合物的晶体。获得晶体后对其进行检测:
①先取a?g的晶体进行脱水实验,获得无水固体为(a-1.26)g ?
②将无水固体溶于足量的水配成溶液后滴加1.00mol/L的氯化钡溶液,当滴加10.00mL溶液时,沉淀恰好完全。通过计算测知该晶体的化学式是___________________。
(4)氯化亚铜(CuCl)是重要的化工原料。国家标准规定合格的CuCl产品的主要质量指标为CuCl的质量分数大于96.5%?。工业上用硫酸铜等原料常通过下列反应制备CuCl?:2CuSO4+?Na2SO3?+?2NaCl?+?Na2CO3?=?2CuCl?↓+?3Na2SO4?+?CO2↑ 测定CuCl质量分数时先准确称取所制备的0.2500g?CuCl样品置于一定量的0.5mol/L?FeCl3溶液中,待样品完全溶解后,加水20mL,用0.1000mol/L?Ce(SO4)2溶液滴定到终点,消耗24.60mL?Ce(SO4)2溶液。有关反应的离子方程式为:Fe3++CuCl=Fe2++Cu2++Cl-?,Ce4+?+?Fe2+?=?Fe3+?+?Ce3+ ?
通过计算说明上述样品中CuCl的质量分数是否符合标准。
4、选择题 下列推断正确的是( )
| 事?实 | 结?论
A
常温下铁、铜均不溶于浓硫酸
常温下铁、铜与浓硫酸均不反应
B
HCl与Na2CO3溶液反应生成CO2
可用饱和Na2CO3溶液除去CO2中的少量HCl
C
氧化铜高温下生成红色物质,该物质可与稀硫酸反应
氧化铜高温下可分解生成Cu2O
D
稀、浓HNO3分别与铜反应,还原产物为NO和NO2
稀?HNO3氧化性比浓?HNO3强
|