微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 X、Y、Z分别代表3种不同的短周期元素,X元素的原子最外层电子数为1,Y元素原子M层有6个电子,Z元素原子的L层电子数6,由这三种元素组成的化合物的化学式是
A.X3YZ4
B.X2YZ3
C.XYZ4
D.X4YZ4
参考答案:B
本题解析:根据元素的结构可知,X的最高价是+1价,Y是S,Z是O,可组成的化学式应该是选项B,其余都是错误的,答案选B。
本题难度:一般
2、选择题 科学家早在2000年就在英国《自然》杂志上报告,他们用DNA制造出了一种臂长只有7纳米的纳米级镊子,以便能够钳起分子或原子并对它们随意组合。下列分散系中的分散质的粒子直径与纳米粒子具有相同数量级的是
A.溶液
B.悬浊液
C.乳浊液
D.胶体
参考答案:D
本题解析:
本题难度:困难
3、填空题 (10分)现有部分短周期元素的性质或原子结构如下表:
元素编号
| 元素性质或原子结构
|
T
| M层上有2对成对电子
|
X
| 基态原子核外电子共占据5个原子轨道且有2个未成对电子,
|
Y
| 常温下单质为双原子分子,其氢化物水溶液呈碱性
|
Z
| 元素最高正价是+7价
|
(1)元素T的原子最外层共有________种不同运动状态的电子。
(2) 元素Z与元素T相比,非金属性较强的是________(用元素符号表示),
(3)下列表述中能证明“元素Z与元素T相比,非金属性较强的”这一事实的是________。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)元素X和元素Y的第一电离能的大小关系为_________,请说明理由_______________。
(5)CO和Y2是等电子体,CO和Y2的结构均可表示为A≡B的形式(A、B可表示相同元素的原子也可表示不同元素的原子)。下表是两者的键能数据:(单位:kJ/mol)
?
| A-B
| A=B
| A≡B
|
CO
| 357.7
| 798.9
| 1071.9
|
Y2
| 154.8
| 418.4
| 941.7
|
结合数据说明CO比Y2活泼的原因:______________________________________。
参考答案:(1)6(2分) (2) Cl(1分)? (3) b(1分)
(4)N>O(1分)? N原子的外围电子排布式为2s2sp3,2p轨道处于半充满状态,处于能量较低的稳定状态。(2分)
(5)断裂CO中第一个π键的键能是273kJ/mol,断裂N2中第一个π键的键能是523.3kJ/mol,所以CO的第一个键比N2更容易断。(3分)
本题解析:T元素M层上有2对成对电子,则T元素的核外电子排布式为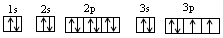 即T元素为S(硫)元素;
即T元素为S(硫)元素;
X元素的基态原子核外电子共占据5个原子轨道且有2个未成对电子,则X元素原子的核外电子数=5×2-2=8,即X元素为O(氧)元素;
Y元素常温下单质为双原子分子,其氢化物水溶液呈碱性,则Y元素为N(氮)元素;
Z元素最高正价是+7价,在短周期中只能是CL(氯)元素;
所以(1)元素T的原子最外层共有6种不同运动状态的电子;
(2)元素Z与元素T为同一周期元素,在同周期中从左至右,元素的非金属性增强,所以非金属性强的为CL;
(3)非金属性强弱的比较依据有:单质与氢气化合的难易、氢化物的稳定性、最高价氧化物对应的水化物—酸性强弱,所以正确选项为b。
(4)N>O?因为N原子的外围电子排布式为2s2sp3,2p轨道处于半充满状态,处于能量较低的稳定状态。
(5)断裂CO中第一个π键的键能是273kJ/mol,断裂N2中第一个π键的键能是523.3kJ/mol,所以CO的第一个键比N2更容易断。
本题难度:简单
4、选择题 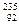 U是制造原
U是制造原 子弹的材料。
子弹的材料。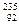 U的原子核内的中子数与核外电子数之差是
U的原子核内的中子数与核外电子数之差是
A ?235?B ?143?C ?92? D 51
参考答案:D
本题解析:略
本题难度:一般
5、计算题 已知Cl有两种天然同位素35Cl、37Cl,Cl的相对原子质量为35.5,Na只有一种原子23Na,求10吨纯度为90%的食盐(杂质中不含Na、Cl)样品中含37Cl多少吨,含Na35Cl多少吨?
参考答案: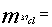 6.6 t ;
6.6 t ;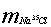 ="1.4" t
="1.4" t
本题解析:可设35Cl和37Cl两种同位素的比例为a:b,则35a+37b=35.5(a+b),得a:b=3:1,所以23Na35Cl和23Na37Cl的物质的量之比为3:1,设Na35Cl有x吨,Na37Cl有y吨,依据题意,可得x+y=10*90%,(x/58):(y/60)=3:1,解得x、y值,再由y值求出37Cl的含量。
点评:本题考查相对原子质量的计算和同位素的知识,依据题意,可求算得混合物中物质含量,综合性较强,题目难度中等。
本题难度:一般