微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (本小题15分)A、B、C、D四元素的核电荷数依次增加,它们的离子的电子层数相同且最外层电子数均为8。A原子的L层电子数与K、M层电子数之和相等,D原子的K、L层电子数之和等于电子总数的一半。回答以下问题:
(1)四元素的符号依次是A______;B______;C________;D______。
(2)写出B、D元素的离子结构示意图:
B.______________________; D.______________________。
(3)用电子式表示A、C元素形成的离子化合物的过程:
________________________________________________________。
(4)在A、B、C、D最高价氧化物水化物中:
比较其中酸的酸性强弱:____________________________;
比较其中碱的碱性强弱:____________________________。
参考答案:
(1) S;Cl;K;Ca(4分,每空1分)
(2) Cl-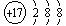 (2分) Ca2+
(2分) Ca2+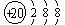 (2分)
(2分)
(3)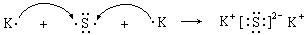 (3分)
(3分)
(4)酸性:HClO4>H2SO4 (2分)?碱性:KOH>Ca(OH)2(2分)
本题解析:因A原子的L层电子数与K、M层电子数之和相等,所以A的核电荷数为2×8=16,A为硫元素。D原子的K、L层电子数之和等于电子总数的一半,所以D原子的核电荷数是(2+8)×2=20,D为钙元素。根据核电荷数依次增大,并都形成离子,排除氩原子和磷元素,B为氯元素,C为钾元素。A、B、C、D最高价氧化物水化物分别为H2SO4、HClO4、应试策略:掌握同周期元素、同主族元素的性质递变规律是解题的关键。
1.同周期元素(从左→右)
①电子层数相同,最外层电子由1→8。
②原子半径逐渐减小。
③失电子能力渐弱、得电子能力渐强,即金属性减弱、非金属性增强。金属单质的还原性减弱,例如:Na>Mg>Al与水反应的能力逐渐减弱。非金属单质的氧化性增强,还原性减弱。例如氧化性:Si<P<S<Cl2,还原性:Si>P>S>Cl2。
④最高价氧化物的水化物:碱性减弱、酸性增加。例如:
NaOH、Mg(OH)2、Al(OH)3、H4SiO4、H3PO4、H2SO4、HClO
强碱?中强碱?两性?弱酸?中强酸?强酸?最强酸
⑤气态氢化物的稳定性渐强、还原性渐弱。
例如:稳定性:SiH4<PH3<H2S<HCl;还原性:SiH4>PH3>H2S>HCl。
2.同主族元素(从上→下)
①最外层电子数相同→化学性质相似。
②电子层数递增,半径递增→化学性质递变。
③非金属性渐弱、金属性渐强。
④最高价氧化物的水化物的酸性减弱、碱性增强。例如:
eq o(sup 2(H2CO3、H4SiO4、H4——————————————————————————————
⑤气态氢化物的稳定性减弱、还原性增强。例如:
eq o(sup 2(HF、? HCl、? HB———————————————————————→
KOH、Ca(OH)2。
本题难度:一般
2、选择题 短周期元素甲和乙,甲原子的最外层电子数为a,次外层电子数为b;乙原子的M层电子数为(a – b – 1),L层电子数为(a + b)。则甲、乙两元素形成的化合物具有的性质是
①与水反应?②与硫酸反应?③与氢氧化钠溶液反应?④与氯气反应
A.①②
B.②③
C.②④
D.③④
参考答案:B
本题解析:由乙原子L层电子数为(a + b),则(a + b)=8,即可得甲原子核外电子排布为2,6结构,所以甲原子为O原子,从而可得乙原子为AL原子,甲、乙两元素形成的化合物为AL2O3,氧化铝为典型的两性氧化物,所以,可与硫酸反应,又可与氢氧化钠溶液反应;
本题难度:一般
3、选择题 第114号元素是化学家和物理学家很感兴趣的尚未发现的元素,推测此元素在周期表中的位置(? )
A.第八周期ⅢA族
B.第六周期ⅤA族
C.第七周期ⅣB族
D.第七周期ⅣA族
参考答案:D
本题解析:已知元素周期表已有112种元素,112号元素在元素周期表第七周期,ⅡB族,因此114在第七周期ⅣA族,故D正确。
本题难度:简单
4、选择题 X元素原子的质量数为m,核内中子数为n,则Wg X2+ 离子含有的电子的物质的量约为( )
A.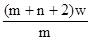 mol
mol
B.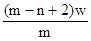 mol
mol
C.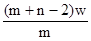 mol
mol
D.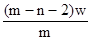 mol
mol
参考答案:D
本题解析:X元素的原子序数是m-n,则X2+ 离子的电子数是m-n-2。所以Wg X2+ 离子含有的电子的物质的量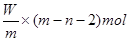 ,所以答案是D。
,所以答案是D。
本题难度:一般
5、选择题 下列电子式不正确的是
A.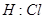
B.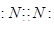
C.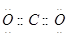
D.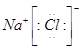
参考答案:A
本题解析:氯化氢中氯原子还存在不参与成键的电子,正确的电子式为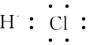 ,其余都是正确的,答案选A。
,其余都是正确的,答案选A。
本题难度:简单