微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 一个化学电池的总反应方程式为:Zn+Cu2+==Zn2++Cu,该化学电池的组成可能为
[? ]
正极 负极 电解质溶液
A.Cu Zn H2SO4
B.Cu Zn CuSO4
C.Zn Cu ZnCl2
D.Fe Zn CuCl2
参考答案:BD
本题解析:
本题难度:简单
2、简答题 (8分)请用相关知识回答下列问题:
(1)用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体,实验过程测得的CO2气体体积随时间变化如右图所示。
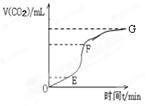
①________段化学反应速率最快,_______段收集的二氧化碳气体最多。
②除加入蒸馏水外,当加入下列物质中的?(填序号)时,则能够减缓上述反应的速率。
A.醋酸钠溶液? B.碳酸钙粉末? C.稀硫酸? D.浓盐酸
(2)原电池是一种能量装置。
①下列在理论上可用来设计原电池的反应是?(填序号)。
A.NaOH +HCl==NaCl+H2O ?B.2FeCl3+Cu=2FeCl2+CuCl2
C.CuSO4 +2NaOH== Cu(OH)2+NaSO4?D.C2H6O +3O2==3H2O+2CO2
②实验室中用锌片与硫酸反应制取氢气时,向反应溶液中滴加几滴CuSO4溶液,可以发现产生氢气速率明显加快,其原因是?。
参考答案:(1)①EF、EF;②AC;
(2)①BD;②锌与硫酸铜发生置换反应形成锌铜原电池,能加快反应速率。
本题解析:(1)有图像可知:在EF段单位时间内产生的CO2气体最多。因此化学反应速率最快。在EF段收集的二氧化碳气体的物质的量也最多。[②A.加入醋酸钠溶液,发生反应强酸HCl变为弱酸CH3COOH,c(H+)减小,反应速率减慢。正确。B.碳酸钙粉末,由于固体的接触面积增大,所以反应速率加快。错误。C.稀硫酸,发生反应产生难溶性的硫酸钙,附着在碳酸钙的表面,使物质接触面积减小,反应速率减慢。正确。D.浓盐酸c(H+)增大,反应速率加快。错误。(2)①原电池是摆化学能转化为电能的装置。因此若能设计为原电池,该反应应该是氧化还原反应。只有BD符合题意。②实验室中用锌片与硫酸反应制取氢气时,向反应溶液中滴加几滴CuSO4溶液,首先发生反应:Zn+ CuSO4= Cu+ZnSO4。产生的Cu附着在Zn上,Zn、Cu及硫酸就构成邻位原电池。由于发生原电池反应,所以反应速率大大加快。
本题难度:一般
3、选择题 下列说法正确的是( )
A.钢铁发生电化腐蚀的正极反应式:Fe→Fe2++2e-
B.氢氧燃料电池的负极反应式:O2+2H2O+4e-→4OH-
C.粗铜精炼时,与电源正极相连的是纯铜
D.用惰性电极电解饱和食盐水时,阳极的电极反应式2Cl--2e-→Cl2↑
参考答案:A.钢铁发生电化学腐蚀时,Fe为负极,则负极反应式为Fe→Fe2++2e-,正极反应可能为析氢或吸氧的反应,故A错误;
B.氢氧燃料电池负极为氢气,正极为氧气,则正极反应式为O2+2H2O+4e-→4OH-,故B错误;
C.粗铜精炼时,粗铜作阳极,与电源正极相连,则与电源负极相连的是纯铜,故C错误;
D.用惰性电极电解饱和食盐水时,阳极上阴离子放电,所以阳极的电极反应式2Cl--2e-→Cl2↑,故D正确;
故选D.
本题解析:
本题难度:一般
4、选择题 一种碳纳米管能够吸附氢气,用这种材料制备的二次电池原理如图所示,该电池的电解质为6 mol/L KOH溶液,下列说法中正确的是

[? ]
A.放电时K+移向负极
B.放电时电池负极的电极反应为:H2-2e-=2H+
C.放电时电池正极的电极反应为:NiO(OH)+H2O+e-=Ni(OH)2+OH-
D.该电池充电时将碳电极与电源的正极相连
参考答案:C
本题解析:
本题难度:一般
5、选择题 下列关于如图所示装置的叙述中正确的是( )

A.可将电能转化为化学能
B.铜是正极,铜片上有气泡产生
C.电流从锌片经导线流向铜片
D.氢离子在锌片表面被还原
参考答案:A.如图装置为原电池装置,将化学能转化为电能,故A错误;
B.电池工作时,活泼金属Zn为负极,失电子被氧化,铜为正极,氢离子在正极得电子被还原生成氢气,有气泡,故B正确;
C.电流由正极(Cu)经导线流向负极(Zn),故C错误;
D.氢离子在正极(Cu)得电子被还原生成氢气,故D错误.
故选B.
本题解析:
本题难度:简单