微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 A、B、C、D、E五种短周期元素从左到右原子序数依次增大(原子序数为5个连续的自然数),下列说法中正确的是
①E元素的最高化合价为+7时,D元素的负化合价可为-2? ②A(OH)n为强碱时,B(OH)m也一定为强碱
③HnDOm为强酸时,E的非金属性一定很强? ④HnCOm为强酸时,E的单质可能有强氧化性
A.①④
B.①②?
C.①③
D.③④
参考答案:A
本题解析:E的原子序数最大,所以有可能是第ⅦA元素,则D就有可能是第ⅥA,①正确。NaOH是强碱,但Mg(OH)2不是强碱,②不正确。HnDOm为强酸,但不一定是最高价氧化物对应的水化物,即E的非金属性可能很强,也可能不是很强,所以③不正确,④正确。答案A。
本题难度:困难
2、选择题 元素的性质呈周期性变化的根本原因是
A.元素原子量的递增,量变引起质变
B.元素的原子半径呈周期性变化
C.元素的金属性和非金属性呈周期性变化
D.元素原子的核外电子排布呈周期变化
参考答案:D
本题解析:试题分析:随原子序数的递增,原子的结构呈现周期性的变化而引起元素的性质的周期性变化。因原子的核外电子排布中电子层数和最外层电子数都随原子序数的递增而呈现周期性变化,则引起元素的性质的周期性变化。
考点:原子结构与元素周期率的关系、元素周期律和元素周期表的综合应用
本题难度:简单
3、选择题 已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C 在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料。下列说法正确的是
[? ]
A.工业上常用电解法制备元素C、D、E的单质
B.元素A、B组成的化合物常温下一定呈气态
C.化合物AE与CE含有相同类型的化学键
D.元素C、D的最高价氧化物对应的水化物之间不可能发生反应
参考答案:A
本题解析:
本题难度:一般
4、选择题 下列各组中顺序的排列不正确的是
A.酸性:HClO4>H2SO4>H3PO4>H2SiO3
B.稳定性:HF>H2O>H2S
C.碱性:KOH>NaOH>Mg(OH)2
D.熔沸点:HI>HBr>HCl>HF
参考答案:D
本题解析:考查元素周期律的应用。同周期元素自左向右金属性逐渐减弱,非金属性逐渐增强。同主族元素自上而下金属性逐渐增强,非金属性逐渐减弱。金属性越强相应最高价氧化物的水化物的碱性就越强。非金属性越强,相应氢化物的稳定性就越强,最高价氧化物对应水化物的酸性就越强,因此选项ABC均正确。应用HF分子中存在氢键,所以其熔沸点在四种氢化物中是最高的,正确的顺序为HF>HI>HBr>HCl。答案选D。
本题难度:简单
5、简答题 下表为元素周期表的一部分,请参照①~⑩在表中的位置,用化学用语回答下列问题:
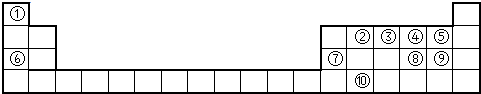
(1)元素③形成的单质的电子式为______;元素②形成的最高价氧化物的结构式为______.
(2)⑥、⑦两元素的最高价氧化物的水化物之间反应的离子方程式为______.
(3)②、③、④、⑤元素形成的氢化物中,热稳定性最强的是______(填化学式),沸点最高的是______(填化学式).
(4)⑧、⑨元素的最高价氧化物的水化物酸性强弱比较______(填化学式).
(5)元素⑩在周期表中的位置______;该元素的单质主要用途______(选填一种).
参考答案:(1)表中③是N,N2的电子式是

;②是C,其最高氧化物是CO2,其结构式为O=C=O,故答案为:

;O=C=O;
(2)⑥、⑦分别是Na、Al,其最高价氧化物的水化物分别是NaOH和Al(OH)3,二者反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(3)②、③、④、⑤分别是C、N、O、F,根据同周期从左到右元素氢化物稳定性逐渐增强可知,稳定性最强的是HF,沸点最高的应该是H2O,因为在这几种元素的氢化物中只有H2O在常温下是液体,其余是气体(也可从氢键解释),故答案为:HF;H2O;
(4)⑧、⑨分别是S、Cl,根据同周期最高价氧化物的水化物从左到右酸性逐渐增强可知,酸性为:HClO4>H2SO4,故答案为:HClO4>H2SO4;
(5)⑩是Ge,处于周期表中的第4周期ⅣA族,与Si一样可做半导体材料,故答案为:第4周期ⅣA族;半导体材料.
本题解析:
本题难度:一般