微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列实验“操作和现象”与“结论”对应关系正确的是
[? ]
操作和现象
结论
A.
处理锅炉水垢中的CaSO4时,依次加入饱和Na2CO3溶液和盐酸,水垢溶解
溶解度: S(CaCO3)<S(CaSO4)
B.
用石墨作电极电解MgSO4溶液,某电极附近有白色沉淀生成
该电极为阳极
C.
向FeCl3和CuCl2混合溶液中加入铁粉,有红色固体析出
氧化性:Cu2+>Fe3+
D.
向某溶液中先滴加硝酸酸化,再滴加BaCl2溶液,有白色沉淀生成
该溶液中一定含有Ag+
参考答案:A
本题解析:
本题难度:一般
2、选择题 用X、Y、Z、w四种金属进行如下实验:

根据以上事实.下列判断或推测错误的是
A.上述四种金属中.Z的单质还原性最弱
B.w的还原性强于Y的还原性
C.Z放人CuSO4溶液中一定有Cu析出
D.用X、Z和稀硫酸可构成原电池.X作负极
参考答案:C
本题解析:将X和Y用导线连接,浸入电解质溶液中,Y极上有气泡产生,说明Y是正极,因此X的金属性强于Y的;将片状的X、W分别投入等浓度盐酸中都有气体产生,W比X反应剧烈,则W的金属性强于X的;用惰性电极电解等物质的量浓度的Y和Z的硝酸盐混合溶液,在阴极上首先析出单质Z,说明Z的金属性弱于Y的,因此金属性强弱顺序是W>X>Y>Z。但Z的金属性不一定强于Cu,所以选项C不正确,其余选项都是正确,答案选C。
考点:考查金属性强弱大小判断
本题难度:一般
3、选择题 某同学为了使反应2HCl+2Ag===2AgCl+H2↑能进行,设计了如图所示的四个实验,你认为可行的方案是( )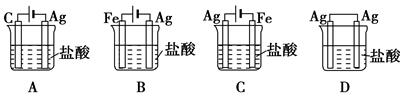
参考答案:C
本题解析:考查电解池的应用。银剩余不活泼的金属,和盐酸不能发生置换反应生成氢气。要是反应能够进行,则必须借助于电解,此时银和电源的正极相连,作阳极,所以选项C是正确的。答案选C。
本题难度:一般
4、选择题 用惰性电极电解NaHSO3溶液可以得到硫酸,装置如图所示,电解过程中①、②、③、④处的生成物依次是
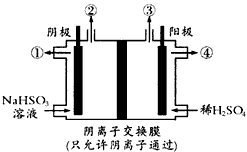
[? ]
A.硫酸、氧气和二氧化硫、氧气、亚硫酸钠
B.硫酸、氢气、氧气和二氧化硫、亚硫酸钠
C.亚硫酸钠、氧气和二氧化硫、氢气、硫酸
D.亚硫酸钠、氢气、氧气和二氧化硫、硫酸
参考答案:D
本题解析:
本题难度:一般
5、选择题 表示下列变化的化学用语正确的是
A.Na2CO3的水解:CO32-+H2O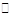 H2CO3+2OH-
H2CO3+2OH-
B.用石墨电极电解硫酸铜溶液:2Cu2++4OH- 2Cu+O2↑+2H2O
2Cu+O2↑+2H2O
C.钢铁发生吸氧腐蚀的正极反应式为:O2 +2H2O+4e- = 4OH-
D.草酸使酸性高锰酸钾溶液褪色:2MnO4—+5C2O42—+16H+=2Mn2++10CO2↑+8H2O