微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 在一个U形管里盛有氯化铜溶液,并插入两块锌片作电极,按如图连接

(1)如果把开关K接A,该装置应是________,Zn(2)极是_________极,电极反应式为___________。
(2)上述反应进行5min后,置换开关K到C,则该装置是_____________,Zn(2)极是___________极,电极反应式是_______________。
(3)上述装置进行2min后,再置换开关K至B,则Zn(1)极发生的化学反应方程式为_____________, Zn(2)极发生的有关电化学的反应方程式为_____________。
参考答案:(1)电解池 ;阳 ;Zn-2e-===Zn2+
(2)原电池 ;正 ;Cu2++2e-===Cu
(3)Zn+CuCl2===Cu+ZnCl2? ;负:Zn-2e-===Zn2+ ;正:Cu2++2e-===Cu
本题解析:
本题难度:一般
2、实验题 (14分)金属钛(Ti)性能优越,被称为继铁、铝之后的“第三金属”。工业上以钛铁矿(主要成分FeTiO3,含FeO、Al2O3、SiO2等杂质)为主要原料冶炼金属钛,其生产的工艺流程图如下:
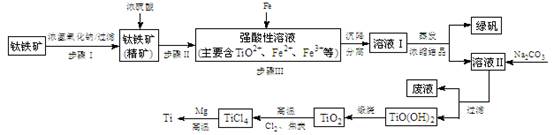
已知:2H2SO4(浓)+ FeTiO3=TiOSO4 + FeSO4 + 2H2O
(1)步骤I中发生反应的离子方程式: 、 。
(2)已知:TiO2+易水解,只能存在于强酸性溶液中。
25 ℃时,难溶电解质溶解度与pH关系如图,
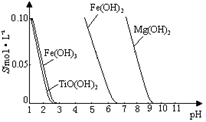
TiO(OH)2溶度积Ksp=1×10-29
①步骤Ⅲ加入铁屑原因 是 。
② TiO2+水解的离子方程式为 。
向溶液II中加入Na2CO3粉末的作用是 。
当溶液pH= 时,TiO(OH)2已沉淀完全。
(3)TiCl4→Ti反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于 ℃即可。
| TiCl4
| Mg
| MgCl2
| Ti
|
熔点/℃
| -25.0
| 648.8
| 714
| 1667
|
沸点/℃
| 136.4
| 1090
| 1412
| 3287
|
(4)电解TiO2制备钛的方法如图所示。该方法由于具备生产过程简化、生产成本低、产品质量高、环境友好等诸多优点而引人注目。已知TiO2熔融状态下不发生电离,电解时阴极反应式为 。

参考答案:(14分)
(1)Al2O3+2OH-=2AlO2-+H2O(或Al2O3+2OH-+3H2O=2[Al(OH)4]-)(2分)
SiO2+2OH-=SiO32-+H2O(2分)
(2)①将Fe3+转化为Fe2+,防止Fe3+与TiO2+同时生成沉淀(2分)
②TiO2++2H2O TiO(OH)2+2H+ (2分)
TiO(OH)2+2H+ (2分)
调节溶液pH值,促进TiO2+水解 (1分) 2(2分)
(3)1412 (1分)
(4)TiO2+4e-=Ti+2O2-(2分)
本题解析:(1)根据钛铁矿的成分可知与氢氧化钠溶液反应的物质是氧化铝和二氧化硅,离子方程式为Al2O3+2OH-=2AlO2-+H2O(或Al2O3+2OH-+3H2O=2[Al(OH)4]-)(2分)
SiO2+2OH-=SiO32-+H2O;
(2)①由图可知TiO(OH)2与Fe(OH)3沉淀的pH很接近,所以加入铁粉目的是将Fe3+转化为Fe2+,防止Fe3+与TiO2+同时生成沉淀;
②TiO2+易水解,只能存在于强酸性溶液中,所以TiO2+水解生成TiO(OH)2与H+ ,离子方程式为TiO2++2H2O TiO(OH)2+2H+ ; 从流程图中可看出加入碳酸钠溶液后得到TiO(OH)2沉淀,所以向溶液II中加入Na2CO3粉末的作用是调节溶液pH值,使TiO2+水解平衡正向移动;由图可知,pH=2时TiO(OH)2已沉淀完全。
TiO(OH)2+2H+ ; 从流程图中可看出加入碳酸钠溶液后得到TiO(OH)2沉淀,所以向溶液II中加入Na2CO3粉末的作用是调节溶液pH值,使TiO2+水解平衡正向移动;由图可知,pH=2时TiO(OH)2已沉淀完全。
(3)Mg、MgCl2的沸点最高是1412℃,而Ti的熔点为1667℃,所以当温度略高于1412℃时Mg、MgCl2以气体的形式除去,得到Ti;
(4)电解时阴极发生还原反应,因为TiO2熔融状态下不发生电离,所以是TiO2得电子生成Ti单质和O2-,电极反应式为TiO2+4e-=Ti+2O2-。
考点:考查物质的制备,流程图的分析,化学平衡的应用,电化学理论的应用
本题难度:一般
3、选择题 用惰性电极电解Fe2(SO4)3和CuSO4的混合溶液,且已知Fe2(SO4)3+Cu=2FeSO4+CuSO4,下列说法正确的是( )
A.阴极反应式为:Cu2++2e-═Cu,当有Cu2+存在时,Fe3+不放电
B.阴极上首先析出铁,然后析出铜
C.阴极先是Fe3+放电,后Cu2+放电
D.阴极上不可能析出铜
参考答案:A.由反应Fe2(SO4)3+Cu=2FeSO4+CuSO4可知,氧化性:Fe3+>Cu2+,则Fe3+得电子能力比Cu2+强,所以,在阴极首先得电子的是Fe3+,当Fe3+存在时,Cu2+不放电,故A错误;
B.当Fe3+完全反应后Cu2+放电,首先析出铜,故B错误;
C.因氧化性:Fe3+>Cu2+,阴极先是Fe3+放电,后Cu2+放电,故C正确;
D.由B分析可知,当Fe3+完全反应后Cu2+放电,可析出铜,故D错误.
故选C.
本题解析:
本题难度:一般
4、选择题 下列有关用惰性电极电解AgNO3溶液的说法不正确的是:
A.电解过程中阴极质量不断增大
B.电解过程中阳极附近的pH不断降低
C.电解一段时间后,向溶液中加入适量的Ag2O固体可使溶液恢复到电解前的状况
D.电解过程中,溶液中电子由阴极迁向阳极
参考答案:D
本题解析:A、电极过程中银镜反应为:Ag++e?=Ag,阴极质量不断增大,正确;B、电解过程中阳极水电离出的OH?失电子:4OH?-4e?=2H2O+O2↑,使水的电离平衡向右移动,H+浓度不断增大,所以pH不断降低,正确;C、电解一段时间后,向溶液中加入适量的Ag2O固体,Ag2O与HNO3反应生成AgNO3和H2O,可使溶液恢复到电解前的状况,正确;D、电解过程中,溶液中阴阳离子移动进行导电,电子不移动,错误。
本题难度:一般
5、选择题 下图为直流电源电解稀Na2SO4水溶液的装置,通电后在石墨电极a和b附近分别滴加石蕊溶液,下列实验现象正确的是
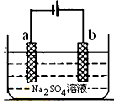
[? ]
A.逸出气体的体积:a电极的小于b电极的
B.一电极逸出无味气体,另一电极逸出刺激性气味气体
C.a电极附近呈红色,b电极附近呈蓝色
D.a电极附近呈蓝色,b电极附近呈红色
参考答案:D
本题解析:
本题难度:一般