微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 已知A、B、C、D、E为周期表里1~20号元素中的五种。又知:①A与D同族,且A、D为非金属元素,B与E同族,B与C同周期;②E的原子序数为奇数,A与E的原子序数之和为28;③0.1mol C单质与足量的E的最高价氧化物对应水化物的溶液反应生成3.36 L(标准状况)的氢气。请回答下列问题:
(1)C的单质与足量的E的最高价氧化物对应的水化物的溶液反应的离子方程式?。
(2)B单质的最高价氧化物的水化物与D的最高价氧化物水化物之间相互反应生0.9 g水时,放出的热量为Q kJ,请写出该反应的热化学方程式?。
(3)请用电子式表示D元素和E元素所构成的化合物的形成过程? 。
。
(4)向⑴所得的溶液中通入过量的CO2气体,过滤后的滤液(不考虑过量二氧化碳的溶解)中各种粒子的数量的从大到小的排序为?。
(5)C单质在日常生活和工业、农业、军事、科技等领域有广泛应用。如在海水中用碳棒和C单质做电极构成原电池,该原电池的正极的电极反应式为?。
参考答案:⑴2Al+2H2O+2OH-=2AlO2-+3H2↑
⑵NaOH(aq)+HClO4(aq)=NaClO4+H2O(l);△H="-20Q" kJ/mol
⑶

⑷H2O、K+、HCO3-、OH-、H2CO3、H+、CO32-
⑸O2+2H2O+2e-=4OH-
本题解析:略
本题难度:一般
2、填空题 (10分)(1)在 H,
H,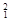 H,
H,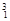 H,
H,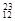 Mg,
Mg,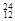 Mg,
Mg,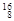 O,
O, O,
O,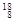 O中共有______种元素,______种原子,中子数最多的是?。D218O的相对分子质量是______。
O中共有______种元素,______种原子,中子数最多的是?。D218O的相对分子质量是______。
(2)人类的生活和生产活动,都离不开能源。在石油、电能、风能、煤碳、天然气、秸杆、水力、水煤气这些能源中,属于“二次能源”的(两种)是____,_??(共1分)属于“不再生能源”的(三种)是___?,?,?_(共1分)。
(3)化学反应的限度是当_?_____和?__相等,反应物和生成物的 _?____保持不变时,所达到的一种看似? 的“平衡状态”。
参考答案:(1) 3, 8,Mg,22
(2)电能、水煤气,石油、煤碳、天然气
(3)正反应速率,逆反应速率,浓度,静止
本题解析:(1)含有相同质子数原子属于同种元素,质子数或中子数不同即为不同的原子;
(2)化石能源不可再生
本题难度:简单
3、选择题 关于氮族元素(从N到Bi)单质及其化合物的性质递变规律说法正确的是(?)
A.单质的熔、沸点依次增大
B.单质磷的化学活泼性比氮气强
C.气态氢化物的还原性依次减弱
D.磷酸的酸性比硝酸强
参考答案:B
本题解析:略
本题难度:一般
4、选择题 下列关于物质性质的比较,不正确的是?
A.金属性强弱:Na>Mg>Al
B.酸性强弱:HIO4>HBrO4>HClO4
C.碱性强弱:KOH>NaOH>LiOH
D.原子半径大小:Na>S>O
参考答案:B
本题解析:A.同周期元素从左到右元素的金属性逐渐减弱,则金属性强弱:Na>Mg>Al,故A正确。
B.非金属性:Cl>Br>I,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,则有HIO4<HBrO4<HClO4,故B错误;
C.金属性:K>Na>Li,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,则碱性强弱:KOH>NaOH>LiOH,故C正确;
D.同周期元素从左到右原子半径逐渐减小,则原子半径Na>S,同主族元素的原子半径从上到下逐渐增大,则原子半径S>O,所以原子半径大小:Na>S>O,故D正确;
故选B。
点评:本题考查元素的性质的递变规律,题目难度不大,注意元素周期律以及元素的性质与元素对应单质、化合物性质的关系。
本题难度:一般
5、选择题 已知钡的金属活动性处于钾和钠之间。则下列变化中可能实现的是
A.钡可从氯化钠溶液中置换出金属钠
B.钡可从冷水中置换出氢气
C.钡可从硫酸铜溶液中置换出铜
D.在溶液中Ba2+可氧化金属锌,生成Zn2+
参考答案:B
本题解析:因为钡的金属活动性处于钾和钠之间,故能与水剧烈反应,B正确;A、钡放入氯化钠溶液中,与溶液中的水反应,故A错误;钡放入硫酸铜溶液中,与水反应,故C错误;钡比锌活泼,钡离子的氧化性比锌离子弱,故不能氧化金属锌生成锌离子,故D错误;故选B。
本题难度:简单