微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 NiSO4?6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有Cu、Zn、Fe、Cr等杂质)为原料获得。工艺流程如下图:

请回答下列问题:
(1)溶解废渣常用一定浓度的稀硫酸,用浓硫酸配制一定浓度的稀硫酸用到的玻璃仪器除烧杯、量筒、玻璃棒外还有: 。
(2)向滤液中滴入适量的Na2S溶液,目的是除去Cu2+、Zn2+,写出除去Cu2+的离子方程式: 。
(3)在40℃左右,用6%的H2O2氧化Fe2+,再在95℃时加入NaOH调节pH,除去铁和铬。此外,除去铁还常用NaClO3作氧化剂,在较小的pH条件下水解,最终生成一种浅黄色的黄铁矾钠[Na2Fe6(SO4)4(OH)12]沉淀除去。下图是温度—pH与生成的沉淀关系图,图中阴影部分是黄铁矾稳定存在的区域(已知25℃时,Fe(OH)3的Ksp = 2.64×10?39)。下列说法正确的是______(选填序号)。
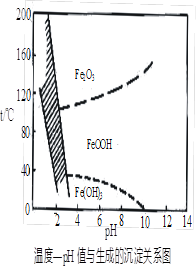
a.FeOOH中铁为+2价
b.若在25℃时,用H2O2氧化Fe2+,再在pH=4时除去铁,此时溶液中c(Fe3+)=2.64×10?27
c.用氯酸钠在酸性条件下氧化Fe2+离子方程式为:6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O
d.工业生产中常保持在85~95℃生成黄铁矾钠,此时水体的pH约为1.2~1.8
(4)上述流程中滤液Ⅲ的主要成分是_________________。
(5)确定步骤④中Na2CO3溶液足量,碳酸镍已完全沉淀的简单实验方法是 。
(6)操作Ⅰ的实验步骤依次为:【实验中可选用的试剂:6mol?L-1的H2SO4溶液,蒸馏水、pH试纸】。
①__________________________________;
②__________________________________;
③ ;
④用少量乙醇洗涤NiSO4?6H2O晶体并晾干。
参考答案:(1)容量瓶 胶头滴管
(2)S2-+Cu2+= CuS↓
(3)cd
(4)Na2SO4 NiSO4
(5)上层清液呈无色
(6) ①过滤,并用蒸馏水洗涤沉淀2~3次直至流出液用pH试纸检验呈中性;
②向沉淀中加6 mol/L的H2SO4溶液,直至恰好完全溶解
③蒸发浓缩、冷却结晶并从溶液中分离出晶体.
本题解析:(1)用浓硫酸配制一定物质的量浓度的稀硫酸用到的玻璃仪器除烧杯、量筒、玻璃棒外还有容量瓶 胶头滴管;(2)Na2S是可溶性盐,溶于水时电离出S2ˉ,S2ˉ与Cu2+易反应生成CuS沉淀,离子方程式为S2-+Cu2+= CuS↓;(3)a.FeOOH中铁为+3价,错误;b.根据25℃时Fe(OH)3的Ksp = c(Fe3+) c3(OH-) =2.64×10?39,pH=4时,c(OH-) =10?10除去铁,此时溶液中c(Fe3+)=2.64×10?9,错误;c.用氯酸钠在酸性条件下氧化Fe2+离子方程式为:6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O,正确;d.分析图像知,工业生产中常保持在85~95℃生成黄铁矾钠,此时水体的pH约为1.2~1.8,正确;选cd;(4)分析流程图知,加Na2S的目的是除去铜、锌等杂质,加H2O2、NaOH的目的是除去铁等杂质,加Na2CO3的目的是除去铬等杂质,因此推断滤液1的主要成分是NiSO4、FeSO4、Cr2(SO4)3、Na2SO4,滤液II的主要成分是NiSO4、Cr2(SO4)3、Na2SO4,滤液III的主要成分是NiSO4、Na2SO4;(5)确定步骤④中Na2CO3溶液足量,碳酸镍已完全沉淀的简单实验方法是上层清液呈无色(6)从NiSO4、Na2SO4及硫酸的混合溶液中制取NiSO4?6H2O晶体,需要蒸发浓缩、冷却结晶并从溶液中分离出晶体。
考点:考查化学工艺流程、物质的制备。
本题难度:困难
2、填空题 某一资料中记载着可以用电解KI水溶液的方法进行KIO3的工业化生产的信息,总的电解反应方程式为:KI+3H2O KIO3+3H2↑。
KIO3+3H2↑。
(1)据此推测:
①阳极反应式是?;
②阴极反应式是?。
(2)一位学生想演示这一方法,则他应该准备的物品和试剂是。
参考答案:(1)①I--6e-+3H2O
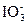 +6H+
+6H+
②6H2O+6e- 3H2↑+6OH-
3H2↑+6OH-
(2)KI溶液、直流电源、导线、两根石墨棒(只要阳极属于惰性电极就可以)、烧杯
本题解析:(1)①阳极是失电子、发生氧化反应的场所,因而氧化反应I-
 在阳极上进行。这一变化过程中失去6个电子,并且需要3个水分子提供3个氧原子,进而产物中会有6个H+生成。综合以上分析可写出阳极上的电极反应式为:I--6e-+3H2O
在阳极上进行。这一变化过程中失去6个电子,并且需要3个水分子提供3个氧原子,进而产物中会有6个H+生成。综合以上分析可写出阳极上的电极反应式为:I--6e-+3H2O
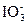 +6H+。②阴极是得电子、发生还原反应的一极,因而还原反应H2O
+6H+。②阴极是得电子、发生还原反应的一极,因而还原反应H2O H2↑在阴极上进行。根据阴阳极电子得失守恒的要求,这一变化过程中应该得到6个电子,导致产物中应该具有含有氧原子并带负电荷的粒子OH-。综合以上分析,可写出阴极上的电极反应式为6H2O+6e-
H2↑在阴极上进行。根据阴阳极电子得失守恒的要求,这一变化过程中应该得到6个电子,导致产物中应该具有含有氧原子并带负电荷的粒子OH-。综合以上分析,可写出阴极上的电极反应式为6H2O+6e- 3H2↑+6OH-。
3H2↑+6OH-。
(2)组成一个电解池需要直流电源、电解质溶液、导线、电源、容器等。
本题难度:简单
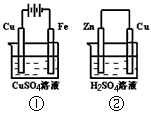
3、选择题 下图两个装置中,溶液体积均为200mL,开始时,电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线上都通过了0.02mol e-,若不考虑溶液体积的变化,则下列叙述正确的是
[? ]
A.在①中Cu棒为阳极;在②中Cu棒为负极
B.电极上析出物质的质量:①<②
C.电极反应式:①中阳极:4OH-一4e-= 2H2O+O2↑;②中负极:2H+ + 2e- = H2↑
D.溶液的pH:①不变;②增大
参考答案:D
本题解析:
本题难度:一般
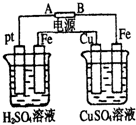
4、选择题 装置如图,通电后,发现Cu极附近溶液蓝色加深.下列说法正确的是( )
A.A极为负极,Cu为阳极
B.左烧杯溶液和右烧杯溶液pH都变小
C.左烧杯溶液浓度变大,右烧杯溶液浓度不变
D.左烧杯Pt极和右烧杯Fe极的电解产物物质的量之比为1:1