微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 随着氮氧化物污染的日趋严重,国家将于“十二五”期间加大对氮氧化物排放的控制力度。目前,消除氮氧化物污染的方法有多种。
(1)用活性炭还原法处理氮氧化物。有关反应为C(s) +2NO(g) N2(g)+CO2(g),某研究小组向某密闭容器中加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g),某研究小组向某密闭容器中加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:

①T1℃时,该反应的平衡常数K=________ (保留两位小数)。
②30 min后,改变某一条件,反应重新达到平衡,则改变的条件可能是_______。
③若30 min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则该反应的
△H______0(填“>”、“=”或“<”)。
(2)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574 kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1 160 kJ/mol
③H2O(g)=H2O(l) △H=-44.0 kJ/mol
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(l)的热化学方程式:______________________。
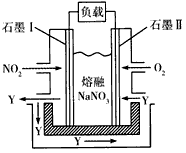
(3)由NO2、O2、熔融NaNO3组成的燃料电池装置如下图所示,在使用过程中石墨I电极上发生反应生成一种氧化物Y,有关电极反应可表示为___________________。
参考答案:(1)①0.56;②减小CO2的浓度;③<
(2)CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l) △H=-955kJ/mol
(3)NO2+NO3--e-=N2O5
本题解析:
本题难度:一般
2、选择题 某温度下,在一固定容积的容器中进行反应H2(g)+I2(g) 2HI(g),下列情况一定能说明反应已达到限度的是(?
2HI(g),下列情况一定能说明反应已达到限度的是(? ? )
? )
A.压强不再随时间而改变时
B.气体的总质量不再改变时
C.混合气体中各组成成分的含量不再改变时
D.单位时间内每消耗1 mol I2,同时有2 mol HI生成时
参考答案:C
本题解析:略
本题难度:一般
3、选择题 在一密闭容器中,反应m A(g)+n B(g) 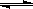 3 C(g)达到平衡时,测得c(A)=0.5 mol/L。在温度不变的情况下,将容器体积增大一倍,当达到新的平衡时,测得c(A)=0.20mol/L。下列判断中正确的是
3 C(g)达到平衡时,测得c(A)=0.5 mol/L。在温度不变的情况下,将容器体积增大一倍,当达到新的平衡时,测得c(A)=0.20mol/L。下列判断中正确的是
A.A的质量分数减小? B.化学计量数:m+n >3
C.平衡向右移动? D.物质C的体积分数减小
参考答案:AC
本题解析:根据将容器体积增大一倍,当达到新的平衡时,测得c(A)浓度小于原浓度的一半,即平衡向正反应方向移动,可知m+n <3。故A选项,A的质量分数变小,正确。B选项,应为m+n <3错误。C选项,平衡向正反应方向移动,正确。D选项,物质C的体积分数正大。
本题难度:一般
4、填空题 (5分)在密闭容器中,当合成氨的反应N2+3H2===2NH3(正反应是放热反应)达到平衡时,改变如下的一些条件:
A.升温,
B.加压,
C.减压,
D.增大c(H2),(E)减小c(NH3),(F)增大c(NH3),若平衡向右移动用“ →”,若平衡向左移动用“←”表示;若值增加用“↑”表示,若值减小用“↓”表示,请根据下表中各项的变化情况,在改变条件栏目中填上相应的编号(每项只改变一个条件)。