微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列事实不能用勒夏特列原理解释的是
A.工业制取金属钾:Na(l)+ KCl(l) NaCl(l)+ K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来
NaCl(l)+ K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来
B.冰镇啤酒瓶,把啤酒倒入玻璃杯,杯中立即泛起大量泡沫。
C.在实验室可用排饱和食盐水的方法收集氯气。
D.对于2HI(g) H2(g)+I2(g);ΔH>0,缩小容器的体积可使颜色变深。
H2(g)+I2(g);ΔH>0,缩小容器的体积可使颜色变深。
参考答案:D
本题解析:能用勒夏特列原理解释的反应必须存在平衡,而且平衡必须移动。A项有化学平衡,而且K以蒸汽的形式从体系中分离出来,平衡移动。B项有溶解平衡,而且压强改变,溶解度减小,平衡移动。C项有溶解平衡,而且同离子效应,平衡移动。D项有化学平衡,但是压强该变平衡没有移动。答案选D。
点评:列夏特列原理是用来解释平衡移动的原理。
本题难度:一般
2、选择题 反应CO(g)+H2O(g) 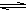 CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1,在800℃时的化学平衡常数K=1.0 。某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1,在800℃时的化学平衡常数K=1.0 。某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
CO
| H2O
| CO2
| H2
|
0.5 mol
| 8.5 mol
| 2.0 mol
| 2.0 mol
|
此时反应中正、逆反应速率的关系式是?
A.v(正)>v(逆)?B.v(正)<v(逆)
C.v(正)=v(逆)? D.无法判断
参考答案:A
本题解析:根据方程式可知反应前后体积不变,则可以设容器的体积是1L,则根据平衡常数的表达式可知 <1,所以反应没有达到平衡状态,此时锌正反应方向进行,则正反应速率大于逆反应速率,答案选A。
<1,所以反应没有达到平衡状态,此时锌正反应方向进行,则正反应速率大于逆反应速率,答案选A。
点评:该题是基础性试题的考查,主要是考查学生对平衡常数含义以及应用的了解掌握情况,意在培养学生灵活运用基础知识解决实际问题的能力的培养,有利于激发学生的学习兴趣,提高学生的应试能力。
本题难度:简单
3、选择题 密闭容器中进行如下反应:X2(g)+3Y2(g)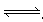 2Z(g),X2、Y2、Z起始浓度分别为0.2 mol·L-1、0.6 mol·L-1、0.4 mol·L-1,当平衡时,下列数据肯定不对的是(?)
2Z(g),X2、Y2、Z起始浓度分别为0.2 mol·L-1、0.6 mol·L-1、0.4 mol·L-1,当平衡时,下列数据肯定不对的是(?)
A.X2为0.4 mol·L-1,Y2为1.2 mol·L-1?
B.Y2为1.0 mol·L-1
C.X2为0.3 mol·L-1,Z为0.2 mol·L-1?
D.Z为0.7 mol·L-1
参考答案:A
本题解析:由极值法可求得:
可逆反应:X2(g)+3Y2(g) 2Z(g)
2Z(g)
始c:? 0.2? 0.6? 0.4
正向到底:? 0? 0? 0.8
逆向到底:0.4? 1.2? 0
所以A是不可能出现的,
本题难度:一般
4、选择题 在恒容密闭容器中,由CO合成甲醇:CO(g) + 2H2(g)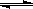 CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如右图所示,下列说法正确的是
CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如右图所示,下列说法正确的是
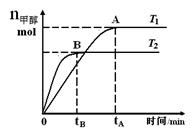
A.平衡常数K = 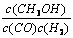
B.该反应在T1时的平衡常数比T2时的小
C.任意时刻,T2温度下的反应速率均大于T1温度下的速率
D.处于A点的反应体系从T1变到T2,达到平衡时 增大
增大
参考答案:D
本题解析:A、根据题给反应知,该反应的平衡常数K =c(CH3OH)/c(CO)c2(H2) ,错误;B、由题给图像可知,温度为T1时,平衡时甲醇的物质的量比T2时大,故该反应在T1时的平衡常数比T2时的大,错误;C、影响反应速率的外界因素有温度,故任意时刻,T2温度下的反应速率均大于T1温度下的速率,错误;D、由题给图像知,处于A点的反应体系从T1变到T2,平衡逆向移动,达到平衡时 增大,正确。
增大,正确。
本题难度:一般
5、填空题 已知:N2O4(g)  2NO2(g) ΔH="+57.20kJ" · mol-1
2NO2(g) ΔH="+57.20kJ" · mol-1
在100℃时,将0.100molN2O4气体充入1L恒容抽空的密闭容器中,每隔一定时间对该容器内的物质浓度进行分析得到下表数据:
时间(s)
| 0
| 20
| 40
| 60
| 80
|
c(N2O4) /mol··L-1
| 0.100
| c1
| 0.050
| c3
| c4
|
c(NO2) /mol·L-1
| 0.000
| 0.060
| c2
| 0.120
| 0.120
|
?
(1) 该反应的平衡常数表达式为? ______;从表中数据分析:
c1?c2 (填“>” 、“<” 或“="”" )。
(2)下列叙述能证明该反应已达到化学平衡状态的是?
A.容器内压强不再发生变化
B.NO2的体积分数不再发生变化
C.容器内气体原子总数不再发生变化
D.相同时间内消耗n mol N2O4的同时生成2n mol NO2
E.反应体系中NO2、N2O4的体积比为1:2
(3)若起始时充入NO2气体0.200mol,则达到平衡时NO2气体的转化率为a;其它条件不变时,下列措施能提高NO2转化率的是??(填字母)。
A.降低温度
B.减小NO2的浓度
C.升高温度
D.增加NO2的浓度
E.再充入一定量的He
参考答案:(1)k=9? ?(2)? AB?(3) AD
?(2)? AB?(3) AD
本题解析:由表框可知c(NO2)="0.120" mol·L-1时反应达到平衡的状态。则此时消耗了四氧化二氮0.6 mol·L-1所以在平衡状态下它的浓度为1-0.6="0.4" mol·L-1所以答案为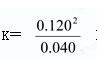 当反应前后的气体化学计量数总和不同时,可从压强去判断是否达到了平衡的状态。B选项其实就是浓度保持不变,所以答案为A、B而C选项不管在什么时候容器内气体原子总数不再发生变化而D选项应为相同时间内消耗n mol N2O4的同时消耗2n mol NO2、E选项不用用来判断是否达到平衡。(3)该反应是吸热反应,所以降低温度反应向逆反应方向移动。所以A可选增大二氧化氮的浓度反应向逆反应方向移动,所以D可选
当反应前后的气体化学计量数总和不同时,可从压强去判断是否达到了平衡的状态。B选项其实就是浓度保持不变,所以答案为A、B而C选项不管在什么时候容器内气体原子总数不再发生变化而D选项应为相同时间内消耗n mol N2O4的同时消耗2n mol NO2、E选项不用用来判断是否达到平衡。(3)该反应是吸热反应,所以降低温度反应向逆反应方向移动。所以A可选增大二氧化氮的浓度反应向逆反应方向移动,所以D可选
本题难度:一般