微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 1932年美国化学家鲍林首先提出电负性的概念.电负性(用X表示)也是元素的一种重要性质,下表给出的是原子序数小于20的16种元素的电负性数值:
| 元素 | H | Li | Be | B | C | N | O | F
电负性
2.1
1.0
1.5
2.0
2.5
3.0
3.5
4.0
元素
Na
Mg
Al
Si
P
S
Cl
K
电负性
0.9
1.2
1.5
1.7
2.1
2.3
3.0
0.8
|
请仔细分析,回答下列有关问题;
(1)预测周期表中电负性最大的元素应为______;估计钙元素的电负性的取值范围:______<X<______.
(2)根据表中的所给数据分析,同主族内的不同元素X的值变化______;?简述元素电负性X的大小与元素金属性、非金属性之间的关系______.?
(3)经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键.试推断AlBr3中形成的化学键的类型为______,其理由是______.
2、选择题 下列物质中,属于电解质的是
A.CuSO4
B.铁
C.NaCl溶液
D.CO2
3、填空题 已知电离能是指1 mol气态原子(或阳离子)失去 l mol电子形成了l mol气态阳离子(或更高价阳离子)所需要吸收的能量。现有核电荷数小于20的元素A,其电离能数据如下:(I1表示气态原子失去第一个电子的电离能;In表示离子失去第n个电子的电离能,单位:eV)
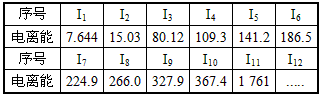
(1)外层电子离核越远,能量越高,电离能越___________(填 “大”或“小”);阳离子电荷数越高,再失去电子时,电离能越___________(填“大”或“小”)。
(2)上述11个电子分属________个电子层。
(3)该元素的主要化合价为_________。
(4)该元素原于的电子排布式为_____________
(5)写出该元素最高价氧化物对应的水化物与稀盐酸反应的离子方程式___________________________。
4、选择题 关于电负性的叙述正确的是
[? ]
A.同族元素原子序数越大,电负性数值越大
B.除稀有气体外,同周期元素原子序数越大,电负性数值越大
C.电负性数值以F=4.0最大,因其最易失去电子
D.电负性数值大者金属性较强,电负性数值小者非金属性较强
5、选择题 下列各组元素中,电负性依次减小的是( )
A.K、Na、Al
B.O、S、H
C.As、P、H
D.O、S、Cl