微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在容积不变的密闭容器中发生反应:2A(g)+B(g)?2C(g)△H<0.某研究小组进行了当其他条件不变时改变某一条件对上述反应影响的研究.下列关于图象的分析正确的是( )
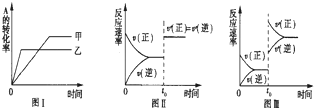
①图Ⅰ研究的是温度对化学平衡韵影响,且乙的温度高于甲的温度?
②图Ⅱ研究的是催化剂对反应速率的影响,化学平衡不移动?
③图Ⅱ研究的是t0时刻通入氦气增大体系压强对反应速率的影响?
④图Ⅲ研究的是t0时刻增大B的浓度对反应速率的影响.
A.①②
B.②③
C.②④
D.③④
参考答案:①正反应反应放热,升高温度平衡向逆反应方向移动,A的转化率减小,则图Ⅰ研究的是温度对化学平衡韵影响,根据曲线斜率可知温度乙大于甲,故①正确;
②t0时刻正逆反应速率都增大,但平衡不移动,应是催化剂对反应速率的影响,故②正确;
③t0时刻通入氦气增大体系压强,但反应物浓度不变,则速率不变,故③错误;
④t0时刻增大B的浓度,正反应速率增大,但逆反应速率在原来基础上增大,故④错误.
故选A.
本题解析:
本题难度:简单
2、实验题 已知KMnO4和H2C2O4在酸性溶液中发生反应:____KMnO4+____H2C2O4+_____H2SO4→____K2SO4+
____MnSO4+_____CO2↑+_____H2O。
(1)配平上述方程式。
甲、乙两个实验小组欲探究影响化学反应速率的因素,设计实验方案如下:
(2)甲组:通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小,实验装置如图所示。
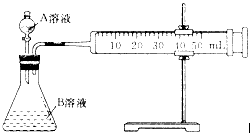
实验时A溶液一次性放下,A,B的成分见下表
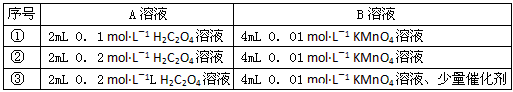
该实验探究的是__________对化学反应速率的影响。在反应停止之前,相同时间内针筒中所得CO2的体积由大到小的顺序是_____________(用实验序号填空)。
(3)乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率的大小。取两支试管各加入
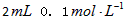 ?H2C2O4溶液,另取两支试管各加入
?H2C2O4溶液,另取两支试管各加入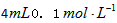 KMnO4溶液。将四支试管分成两组(各有一支盛有H2C2O4溶液和KMnO4溶液的试管),一组放入冷水中,另一组放入热水中,经过一段时间后,分别混合并振荡,记录溶液褪色所需时间。该实验试图探究__________对化学反应速率的影响,但该组同学始终没有看到溶液褪色,其原因是_____________________________________。
KMnO4溶液。将四支试管分成两组(各有一支盛有H2C2O4溶液和KMnO4溶液的试管),一组放入冷水中,另一组放入热水中,经过一段时间后,分别混合并振荡,记录溶液褪色所需时间。该实验试图探究__________对化学反应速率的影响,但该组同学始终没有看到溶液褪色,其原因是_____________________________________。
参考答案:(1)2KMnO4+5H2C2O4+3H2SO4==K2SO4+2MnSO4+10CO2↑+8H2O
(2)浓度和催化剂;③②①
(3)温度;KMnO4溶液过量
本题解析:
本题难度:困难
3、实验题 (7分)污鸡净的主要成分是KMnO4和H2C2O4,可用于洗涤有霉斑的衣物。某小组同学拟探究H2C2O4浓度对反应速率的影响。
实验仪器
I.实验原理
2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O。
II.实验设计
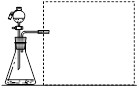
(1)【方案一】测量气体产物:在相同温度下,利用下图装置,测定不同浓度H2C2O4溶液与KMnO4反应产生相同体积CO2所需的时间(忽略CO2溶解性的影响)。下图方框中应选择 (填编号)仪器组装量气装置,限选以下仪器:
①广口瓶、②双孔塞、③水槽、④橡胶管、⑤导管、⑥量筒、⑦秒表。
(2)【方案二】观察反应现象:在其它相同条件下,测定不同浓度H2C2O4溶液与等体积等浓度KMnO4溶液混合后,溶液褪色所需的时间。拟定实验数据:
实验序号
| 温度/℃
| 各物质的体积 / mL
| 反应时间
|
H2O
| 3 mol/L稀硫酸
| 0.1mol/L KMnO4溶液
| 0.6 mol/LH2C2O4溶液
|
1
| 25
| 3.0
| 2.0
| 4.0
| 6.0
| t1
|
2
| 25
| ①
| 2.0
| 4.0
| 4.0
| t2
|
3
| ②
| 7.0
| 2.0
| 4.0
| 2.0
| t3
|
表中①、②处的数据分别是 、 。
III.讨论与交流
(3)小组同学在处理一系列的实验数据时,发现速率(v)-时间(t)曲线如下图所示。他们认为:0~t时间内,速率变快的可能原因是 。
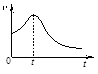
(4)实验室常用KMnO4标准溶液滴定某浓度草酸。KMnO4溶液置于 (填仪器名称)中,判断到达滴定终点的现象是 。若滴开始时,滴定管中有气泡,滴定结束时气泡消失,则测定结果 (填“偏高”、“偏低”、“无影响”)。
参考答案:(1)③⑤⑥或①②④⑤⑥
(见右图)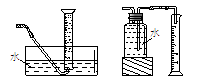
(2)①5.0 ②25
(3)生成的Mn2+起催化作用
(4)酸式滴定管 溶液由无色变为浅紫红色,且半分钟内不褪色 偏高
本题解析:(1)用排水法测量气体的体积,如图所示: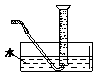 ,所需仪器有③水槽、⑤导管、⑥量筒或如图所示:
,所需仪器有③水槽、⑤导管、⑥量筒或如图所示: ,所需仪器有①广口瓶、②双孔塞、④橡胶管、⑤导管、⑥量筒;(2)在相同温度下,测定不同浓度H2C2O4溶液与等体积等浓度KMnO4溶液混合后,溶液褪色所需的时间,实验时溶液的体积相同,H2C2O4的浓度不同,则②应为25℃,由①③数据可知溶液总体积为15mL,则①为5mL;(3)影响化学反应速率的因素主要有温度、浓度、压强和催化剂,反应为放热反应,温度升高,且生成的锰离子对反应可能起到催化作用,都可加快反应速率,随着反应的进行,浓度逐渐降低,此时反应速率又减小,答案为:①产物Mn2+是反应的催化剂、②该反应放热使温度升高;(4)高锰酸钾具有腐蚀性,应放在酸式滴定管中,达到滴定终点时,溶液由无色变为浅紫红色,且半分钟内不褪色;若读取滴定管数据时,起始读数正确,终点仰视读数,导致所读体积偏大,即需要的高锰酸钾的体积偏大,则测定的浓度偏高。
,所需仪器有①广口瓶、②双孔塞、④橡胶管、⑤导管、⑥量筒;(2)在相同温度下,测定不同浓度H2C2O4溶液与等体积等浓度KMnO4溶液混合后,溶液褪色所需的时间,实验时溶液的体积相同,H2C2O4的浓度不同,则②应为25℃,由①③数据可知溶液总体积为15mL,则①为5mL;(3)影响化学反应速率的因素主要有温度、浓度、压强和催化剂,反应为放热反应,温度升高,且生成的锰离子对反应可能起到催化作用,都可加快反应速率,随着反应的进行,浓度逐渐降低,此时反应速率又减小,答案为:①产物Mn2+是反应的催化剂、②该反应放热使温度升高;(4)高锰酸钾具有腐蚀性,应放在酸式滴定管中,达到滴定终点时,溶液由无色变为浅紫红色,且半分钟内不褪色;若读取滴定管数据时,起始读数正确,终点仰视读数,导致所读体积偏大,即需要的高锰酸钾的体积偏大,则测定的浓度偏高。
考点:考查探究影响化学反应速率的因素。
本题难度:困难
4、选择题 下列措施肯定能使化学反应速率增大的是( )
A.增大反应物的量
B.增加压强
C.升高温度
D.使用催化剂
参考答案:A.若反应物为纯固体或纯液体,增大反应物的量,反应速率不变,故A不选;
B.若反应中没有气体参加和生成,为溶液中的反应,则增加压强,反应速率不变,故B不选;
C.因升高温度,活化分子百分数增大,反应速率加快,故C选;
D.催化剂能改变反应速率,可加快也可减慢,故D不选;
故选C.
本题解析:
本题难度:一般
5、选择题 CO(g)+H2O(g) H2(g)+CO2(g)ΔH
H2(g)+CO2(g)ΔH
参考答案:
本题解析:
本题难度:一般