微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列反应的离子方程式书写正确的是
A.碳酸钙溶于醋酸:CaCO3+2H+═Ca++CO2↑+H2O
B.锌片插入硝酸银溶液中:Zn+Ag+═Zn2++Ag
C.在稀氨水中通入过量CO2:NH3?H2O+CO2═NH4++HCO3-
D.硫酸镁溶液和氢氧化钡溶液反应:SO42-+Ba2+═BaSO4↓
参考答案:C
本题解析:
分析:A.醋酸在离子反应中保留化学式;
B.电荷不守恒;
C.反应生成碳酸氢钠;
D.漏写氢氧化镁的离子反应.
解答:A.碳酸钙溶于醋酸的离子反应为CaCO3+2HAC═Ca2++CO2↑+H2O+2AC-,故A错误;
B.锌片插入硝酸银溶液中的离子反应为Zn+2Ag+═Zn2++2Ag,故B错误;
C.在稀氨水中通入过量CO2的离子反应为NH3?H2O+CO2═NH4++HCO3-,故C正确;
D.硫酸镁溶液和氢氧化钡溶液反应的离子反应为Mg2++2OH-+SO42-+Ba2+═BaSO4↓+Mg(OH)2↓,故D错误;
故选C.
点评:本题考查离子的共存,明确发生的化学反应是解答本题的关键,注意与量有关的离子反应,题目难度中等.
本题难度:简单
2、选择题 某溶液中存在较多的OH-、K+、CO32-,该溶液中还可能大量存在的是
A.H+
B.Ca2+
C.SO42-
D.NH4+
参考答案:C
本题解析:试题分析:离子间如果发生化学反应,则不能大量共存,反之是可以的。氢离子能和OH-及CO32-反应,不能大量共存;Ca2+能和CO32-反应,不能大量共存;NH4+能和OH-反应,不能大量共存,所以正确的答案选C。
考点:考查离子共存的正误判断
点评:该题是高考中的高频题,属于中等难度的试题,试题侧重考查学生的能力。该题需要明确离子不能大量共存的一般情况,即(1)能发生复分解反应的离子之间;(2)能生成难溶物的离子之间;(3)能发生氧化还原反应的离子之间;(4)能发生络合反应的离子之间(如 Fe3+和 SCN-);解决离子共存问题时还应该注意题目所隐含的条件,题目所隐含的条件一般有:(1)溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;(2)溶液的颜色,如无色时可排除 Cu2+、 Fe2+、Fe3+、MnO4-等有色离子的存在;(3)溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;(4)是“可能”共存,还是“一定”共存等。
本题难度:困难
3、选择题 下列实验中,有沉淀产生且不会消失的是( )
A.向澄清的石灰水中通入过量的二氧化碳
B.向硅酸钠溶液中通入过量的二氧化碳
C.向AlCl3溶液中逐滴滴入稀硫酸
D.将NaOH溶液逐滴滴入AlCl3溶液中,直至过量
参考答案:A.沉淀先随气体体积增大而增加,Ca(OH)2全部消耗完后,沉淀先随气体体积增大而减小,直到完全没有沉淀,故A错误;
B.硅酸钠与二氧化碳反应生成硅酸,沉淀不消失,故B正确;
C.AlCl3与稀硫酸不反应,无沉淀生成,故C错误;
D.将NaOH溶液逐滴滴入AlCl3溶液中,直至过量,先生成白色沉淀后沉淀消失,故D错误.
故选B.
本题解析:
本题难度:一般
4、填空题 (8分)有一包白色粉末,其中可能含有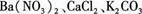 ,现做以下实验。
,现做以下实验。
(1)将部分粉末加入水中,振荡,有白色沉淀生成;
(2)向(1)的悬浊液中加入过量稀硝酸,白色沉淀消失,并有气泡产生;
(3)取少量(2)的溶液滴入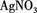 溶液,有白色沉淀生成。
溶液,有白色沉淀生成。
根据上述实验 现象,判断白色粉末中一定含有?(填化学式),可能含自?(填化学式)。写出(3)中有关反应的离子方程式?。
现象,判断白色粉末中一定含有?(填化学式),可能含自?(填化学式)。写出(3)中有关反应的离子方程式?。
参考答案:(8分) CaC l2? K2CO3? Ba(NO3)2? Ag+? + Cl- ="=AgCl↓(" 每空2分)
l2? K2CO3? Ba(NO3)2? Ag+? + Cl- ="=AgCl↓(" 每空2分)
本题解析:略
本题难度:一般
5、选择题 某溶液中含有NO3-、SiO32-、AlO2-、S2-等4种离子,若向其中加入过量的盐酸溶液,微热并搅拌,再加入过量的氢氧化钠溶液,则溶液中离子数目大量减少的是
[? ]
A.只有S2-
B.S2-和NO3-
C.SiO32-、S2-和NO3-
D.四种离子都减少
参考答案:B
本题解析:
本题难度:简单