微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 相同质量的H2SO4与H3PO4中的氢原子数之比为
[? ]
A.2:3
B.3:2
C.1:2
D.2:1
参考答案:A
本题解析:
本题难度:简单
2、计算题 (6分).含CuSO4和H2SO4的混合溶液200mL,其中CuSO4物质的量浓度为1mol.L-1, H2SO4物质的量浓度为0.5mol.L-1,若用此溶液配成0.2mol.L-1 CuSO4和2mol.L-1 H2SO4的混合溶液,试求:
(1)所得溶液的体积是多少毫升?
(2)需加入密度为1.84g.cm-3、98%的浓硫 酸多少毫升?
酸多少毫升?
参考答案:1000ml;103.3ml
本题解析:略
本题难度:简单
3、填空题 (5分)现从固体KOH出发配制0.1mol/L 的KOH溶液 500mL,回答下列问题:
(1)配制过程中需要用到的玻璃仪器有烧杯.玻璃棒.量筒.胶头滴管.
(2)如果在定容时仰视操作,则所配得溶液的浓度 0.1mol/L(填> , =" ," <)
(3)若所用的固体KOH中混有NaOH,则所配得溶液的c(OH-)浓度 0.1mol/L (填> , =" ," <)
(4)若用250mL的H2SO4溶液恰好能将此500mL 0.1mol/L 的KOH溶液中和,则该硫酸的物质的量浓度为 mol/L,其涉及的离子方程式为
参考答案:(5分)(1)500mL容量瓶(2)<(3)>(4)0.1 H++OH-==H2O
本题解析:(1)配制物质的量浓度的溶液的过程中需要用到的玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管、500mL的容量瓶;(2)如果在定容时仰视操作,则会使溶液的体积偏大,则所配得溶液的浓度偏低;因此会小于0.1mol/L;(3)若所用的固体KOH中混有NaOH,由于NaOH的摩尔质量小于KOH,所以等质量的NaOH比KOH含有的OH-的物质的量多,因此会所配得溶液的c(OH-)浓度偏大,故所配得溶液的c(OH-)浓度大于0.1mol/L;(4)若用250mL的H2SO4溶液恰好能将此500mL 0.1mol/L 的KOH溶液中和,根据酸碱中和反应时n(H+)=n(OH-),250mL×2C="500mL×" 0.1mol/L.解得C=0.1mol/L;其涉及的离子方程式为H++OH-==H2O.
考点:考查物质的量浓度的溶液的配制、计算及误差分析的知识。
本题难度:一般
4、选择题 下列各物质中物质的量最多的是(NA表示阿伏伽德罗常数)
A.1molCO2
B.标准状况下44.8LH2
C.3NA个水分子
D.1L 1mol/L的碳酸钠溶液中含的溶质
参考答案:C
本题解析:略
本题难度:简单
5、计算题 有一硫酸和硝酸的混合溶液,取出其中的10mL,加入足量 BaCl2溶液,将生成的沉淀滤出洗净,烘干称得其质量为9.32g;另取此溶液10mL与4.00 mol·L-1的NaOH溶液25mL恰好完全中和。求:
①混合液中硫酸的物质的量浓度是多少?
②混合液中硝酸的物质的量浓度又是多少?
③若将9.6g铜片投入到10mL的混合溶液中,则标况下能生成气体多少毫升?
参考答案:(1)混酸中只有硫酸和氯化钡反应生成沉淀,反应式为
H2SO4+BaCl2=2HCl+BaSO4↓
1mol? 233g
cV? 9.32g
所以有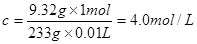
(2)强酸和氢氧化钠反应的离子方程式为H++OH-=H2O。恰好反应。说明氢离子的物质的量和OH-的物质的量相等,所以有4.0mol/L×0.01L×2+c(HNO3)×0.01L=4.0mol/L×0.025L,解得c(HNO3)=2.0mol/L。
(3)9.6g铜是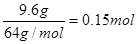 ,10mL的混合溶液中硫酸是0.04mol,硝酸是0.02mol,所以氢离子的物质的量是0.1mol。硝酸和铜反应的离子方程式为
,10mL的混合溶液中硫酸是0.04mol,硝酸是0.02mol,所以氢离子的物质的量是0.1mol。硝酸和铜反应的离子方程式为
3Cu?+? 8H+?+? 2NO3-=3Cu2++4H2O+2NO↑
3mol? 8mol? 2mol?2mol
0.15mol? 0.1mol? 0.02mol
所以铜和氢离子是过量的,NO3-是不足的,即NO3-被完全还原生成NO,所以NO的物质的量是0.02mol,其标准状况下的体积是0.02mol×22.4L/mol=0.448L。
本题解析:考查根据化学方程式进行的有关计算。这种类型的计算,关键是弄清楚发生的反应,并正确写出有关的化学反应方程式,然后根据条件列式进行计算即可。如果反应物的量都是已知的还要判断过量。因为硫酸和铜不反应,但可以提供氢离子,所以只要氢离子足量,硝酸就有可能被完全还原,所以在判断过量时要用离子方程式进行判断。
本题难度:一般