比较该一元酸与盐酸酸性的强弱
参考答案:C
本题解析:非金属性越强,其单质与氢气的化合就越容易,A能够达到实验目的;非金属性越弱,最高价氧化物的水化物的酸性就越弱,相应的钠盐就越容易水解,碱性就越强,所以选项B可以达到目的;金属性强弱和金属阳离子与氨水的反应无关系,C不正确;酸越强,在相同条件下溶液的导电性就越强,则选项D也能达到目的,答案选C。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,在注重对学生基础知识巩固和训练的同时,侧重对学生解题能力的培养和方法的指导与训练,有利于培养学生的逻辑推理能力和规范严谨的实验设计能力。该题的关键是明确金属性和非金属性的判断依据,然后结合题意灵活分析、判断即可。
本题难度:简单
3、选择题 为测定放置已久的小苏打样品中纯碱的质量分数,设计如下实验方案:
⑴方案一:称取一定质量的样品,置于坩埚中加热至恒重后,冷却,称取剩余固体质量,计算。实验中加热至恒重的目的是?。
⑵方案二:按下图装置进行实验。并回答以下问题。
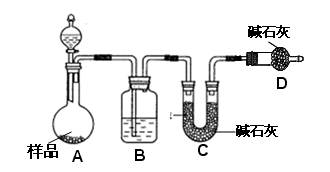
①实验前先_____________________。分液漏斗中应该装_____(盐酸或硫酸)。D装置的作用是?。
②实验中除称量样品质量外,还需称___________装置前后质量的变化。
③根据此实验得到的数据,测定结果有误差。因为实验装置还存在一个明显缺陷,该缺陷是??。
⑶方案三:称取一定量样品,置于小烧杯中,加适量水溶解,向小烧杯中加入足量氯化钡溶液。过滤、洗涤,干燥沉淀,称量固体质量,计算:
①过滤操作中,除了烧杯外还用到的玻璃仪器有_______________;
②实验中判断沉淀是否完全的方法是 ?。
③如加入试剂改为氢氧化钡,已知称得样品9.5g,干燥的沉淀质量为19.7g,则样品中碳酸钠的质量分数为____________(计算结果保留两位有效数字)。
参考答案:方案一(1) 保证NaHCO3全部分解?(2分)
方案二(2)①检查装置的气密性(1分)?硫酸 (1分)
防止空气中水蒸气、CO2进入C管被吸收(1分)?② C(1分)
③需设计一将A、B中的CO2全部吹入C中吸收的气体装置(2分)
方案三(3)①玻璃棒. 漏斗(2分)?
②在反应后小烧杯的上清液中,再滴加BaCl2溶液少许,如无白色沉淀生成说明沉淀完全(2分)
③ 56%(2分)
本题解析:略
本题难度:简单
4、实验题 氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等。某化学兴趣小组模拟工业原理制备氨基甲酸铵,反应的化学方程式如下:2 NH3(g)+CO2(g)  ?NH2COONH4(s)? ΔH<0 ?NH2COONH4(s)? ΔH<0
(1)实验室制备NH3的化学方程式是:?。
(2)制备氨基甲酸铵的装置如下图所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。
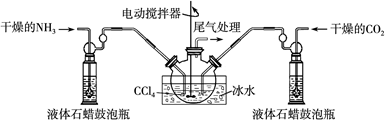
注:四氯化碳与液体石蜡均为惰性介质。
①发生器用冰水冷却的原因是?。液体石蜡鼓泡瓶的作用是?。
②从反应后的混合物中分离出产品的实验方法是?(填写操作名称)。为了得到干燥产品,应采取的方法是?(填写选项序号)。
a. 常压加热烘干? b. 高压加热烘干? c. 真空40 ℃以下烘干
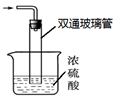
③尾气处理装置如右图所示。双通玻璃管的作用:?;?
浓硫酸的作用:? ? ?。
(3)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品0.7825 g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.000 g。则样品中氨基甲酸铵的物质的量分数为?。
参考答案:(1)2NH4Cl + Ca(OH)2△2NH3 ↑+ CaCl2 + 2H2O(未写条件扣1分)(2分)
(2)① 降低温度,提高反应物转化率(或降低温度,防止因反应放热造成产物分解)(2分);通过观察气泡,调节NH3与CO2通入比例(2分)② 过滤(1分)? c(1分)
③防止倒吸(2分)吸收多余氨气,防止空气中水蒸气进入反应器使氨基甲酸铵水解(2分)
(3)75%(3/4、0.75,其它结果不给分)(3分)
本题解析:(1)实验室制备NH3的化学方程式是2NH4Cl + Ca(OH)2 2NH3 ↑+ CaCl2 + 2H2O。 2NH3 ↑+ CaCl2 + 2H2O。
(2)①因为反应放热,降低温度,提高反应物转化率,同时,防止因反应放热造成产物分解;通过观察气泡,调节NH3与CO2通入比例②反应后的固体和液体的混合物,分离出产品的实验方法是过滤。因为氨基甲酸铵热稳定性差,为了得到干燥产品,应采取的方法是真空40 ℃以下烘干;③图中尾气处理装置使用了截面积较大的玻璃管,可防止倒吸;浓硫酸可以吸收多余氨气,防止空气中水蒸气进入反应器使氨基甲酸铵水解。
(3)由NH2COONH4——CaCO3可知0.7825 g NH2COONH4是0.0133mol,1.000 g CaCO3是0.01mol,样品中氨基甲酸铵的物质的量分数为75%。
本题难度:一般
5、选择题 要证明某溶液中不含Fe3+而可能含有Fe2+.进行如下实验操作时最佳顺序为( )?
①加入足量氯水?②加入足量KMnO4溶液?③加入少量NH4SCN溶液.
A.③①
B.③②
C.①③
D.①②③
参考答案:因为KSCN与Fe3+作用使溶液显红色,与Fe2+作用无此现象,可以先滴加KSCN溶液,不显红色,说明原溶液不含有Fe3+,
再滴加氯水后显红色,说明滴加氯水后溶液中有Fe3+,证明原溶液含有Fe2+,即③①,
故选A.
本题解析:
本题难度:一般
|