微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列关于Al、Fe、Cu的说法正确的是( )
A.三种金属单质放置在空气中均只生成氧化物
B.保存Fe2(SO4)3溶液时需要加入铁钉
C.无需另选试剂就可以鉴别浓度均为0.1mol?L-1的三种金属的硫酸盐
D.三种金属的活泼性:Al>Cu>Fe
参考答案:A.铜放置在空气中能和二氧化碳、水反应生成碱式碳酸铜,故A错误;
B.铁与硫酸铁反应生成硫酸亚铁,则保存Fe2(SO4)3溶液时不能加入铁钉,故B错误;
C.硫酸铝溶液呈无色,硫酸铜溶液呈蓝色,硫酸铁溶液呈黄色,所以不用其它试剂就可鉴别,故C正确;
D.铁能和铜离子发生置换反应生成铜,所以铁的活泼性大于铜,故D错误;
故选C.
本题解析:
本题难度:简单
2、填空题 化合物甲是由短周期元素组成的陶瓷材料,是一种以共价键相连的物质,具有耐高温、抗冲击、导热性好等优良性质。乙是制备这种材料的起始原料,也是铝土矿的主要成分。制备时采取碳热还原氮化法,即把乙与炭粉按一定比例混合,在流动N2气氛中加热到一定温度即可得到甲和可燃性气体丙,二者原子个数之比均为1:1。8.2g甲与足量的氢氧化钠溶液混合可以得到无色溶液丁,并产生标准状况下4.48L气体戊。
(1)乙的化学式为?,写出它的一种用途?。
(2)甲的晶体类型为?,写出碳热还原氮化法制甲的化学方程式?。
(3)工业制备甲的过程中可能含有的杂质有?。
(4)气体戊的结构式为?,写出甲与足量的氢氧化钠溶液反应的化学方程式为?,验证溶液丁中溶质的实验方法为?。
参考答案:(1)Al2O3?耐高温材料(其他合理均可)?
(2) 原子晶体? Al2O3 + 3C +N2 =2AlN + 3CO?
(3)? Al2O3? C? Al4C3等
(4)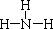 ? AlN + NaOH +H2O=NaAlO2 + NH3?取少量溶液丁于试管中,逐滴加入稀盐酸,若先产生白色沉淀后消失,说明为NaAlO2。
? AlN + NaOH +H2O=NaAlO2 + NH3?取少量溶液丁于试管中,逐滴加入稀盐酸,若先产生白色沉淀后消失,说明为NaAlO2。
本题解析:
试题分析;据题意可知甲物质为二氧化硅,乙物质为氧化铝。二氧化硅为原子晶体。氧化硅与碳在氮气条件下,高温加热,可生成可燃性气体一氧化碳,。所以Al2O3 + 3C +N2 =2AlN + 3CO?。而AlN + NaOH +H2O=NaAlO2 + NH3。,检验NaAlO2的方法是取少量溶液丁于试管中,逐滴加入稀盐酸,若先产生白色沉淀后消失,说明为NaAlO2。主要是利用偏铝酸根离子在酸性条件下可转化为氢氧化铝,而氢氧化铝又溶于强酸的这个性质。
本题难度:一般
3、选择题 在标准状况下,进行甲、乙、丙三组实验:三组各取60 mL同浓度盐酸,加入同一种镁铝合金粉末,产生气体,有关数据列表如下:
实验序号
| 甲
| 乙
| 丙
|
合金质量/mg
| 510
| 770
| 918
|
气体体积/mL
| 560
| 672
| 672
|
则下列说法正确的是(? )
A、甲组和乙组的实验中,盐酸均是过量的?
B、盐酸的物质的量浓度为0.8 mol/L
C、合金中镁铝的物质的量之比为1∶1?
D、丙组中铝的物质的量为0.009 mol
参考答案:C
本题解析:丙在乙的基础上增加合金的质量,但氢气的体积不变,说明在乙中盐酸是不足的,A不正确。氢气是0.672L÷22.4L/mol=0.03mol,所以根据氢原子守恒可知,氯化氢的物质的量是0.06mol,起浓度是0.06mol÷0.06L=1.0mol/L,B不正确。甲中合金全部反应,生成氢气是0.025mol,设镁、铝的物质的量分别是x、y,则x+1.5y=0.025、24x+27y=0.51,解得x=y=0.01mol,所以选项C正确。丙组中铝的物质的量为918÷510×0.01=0.018mol,D不正确,答案选C。
本题难度:一般
4、选择题 两份铝屑,一份与过量HCl反应,另一份与过量NaOH溶液反应,产生的H2体积比为1:2,则两份铝屑的质量比为( )
A.1:2
B.1:1
C.1:3
D.2:1
参考答案:铝屑与过量HCl反应,铝与过量NaOH溶液反应,两份铝产生的H2体积比为1:2,
所以两份铝产生H2的物质的量比为1:2.
根据电子转移守恒,所以两份铝提供的电子的物质的量之比为1:2,
所以两份铝的物质的量之比为1:2.
故选:A.
本题解析:
本题难度:简单
5、选择题 区别镁和铝最好的方法是:取少量试样,然后?(?)
A.投入沸水中
B.投入冷水中
C.投入盐酸中
D.投入NaOH溶
参考答案:D
本题解析:铝既能与强碱反应又能与强酸反应,而镁不能与碱反应;
本题难度:简单