微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 现有等物质的量的Mg和Al的混合物a g与100 ml盐酸反应,(气体体积均以标准状况计算)
(1)、该混合物中Mg和Al的质量比为?
(2)、如果金属与盐酸恰好完全反应,则盐酸的浓度为?
(3)、如果反应后金属有剩余,盐酸不足,要计算生成H2的体积,还需要知道?
参考答案:
(1)、质量比为 8:9?(2)、盐酸的浓度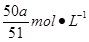
(3)、还需要知道盐酸的浓度或者盐酸的体积
(4)、H2的体积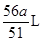
(5)、范围?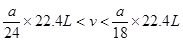
本题解析:
(1)设Mg是XgAl是Yg;则有X24=Y/27,可知X:Y=8:9
(2)根据电荷守恒可得:Mg→Mg2+,Al→Al3+ ,则有:[(8/17/24)2+(9/17/27)3]a/0.1=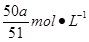
(3)H2中的氢全部来自于盐酸,所以只需知道盐酸的物质的量,就可知道生成的氢气的体积,题干中已知盐酸体积,所以只需知道盐酸的浓度即可。
点评:本题涉及到了混合物与酸反应的定量计算,计算难度提升,学生在解题时不但利用方程式解析,还需要利用元素守恒,电荷守恒等。
本题难度:简单
2、填空题 盐R的化学式为XmYbZp(X、Y、Z为三种不同离子),其组成元素均为短周期元素,取两份等质量等浓度R的水溶液各5 mL进行如下实验:
I.取一份R的水溶液与过量的Ba(OH)2溶液反应,反应过程中生成白色沉淀,沉淀量先增加后减少,最终剩余沉淀甲2.33 g,且甲不溶于稀盐酸。
Ⅱ.取另一份R的水溶液与过量的NaOH溶液混合加热,生成具有刺激性气味的气体乙0.112 L(标准状况),乙能使湿润的红色石蕊试纸变蓝。
据此回答:
(1)写出R和甲的化学式:R___,甲____。
(2)另取1 LR的水溶液,向其中逐滴加入NaOH溶液,所得沉淀与加入NaOH的物质的量关系如图所示。则:
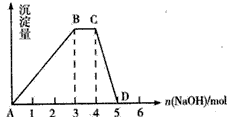
①R溶液的物质的量浓度为____。
②BC段表示的含义是____。
③CD段反应的离子方程式为____。
参考答案:(1)NH4Al(SO4)2 ; BaSO4
(2)①1 mol·L-1
②NH4+与OH -结合生成NH3·H2O
③Al(OH)3+OH-==AlO2-+2H2O
本题解析:
本题难度:一般
3、选择题 14g铜、银合金与足量的某浓度的硝酸反应,将放出的气体与1.12L(标准状况下)氧气混合,通入水中恰好全部被吸收,则合金中铜的质量为 (? )
A.9.6g
B.6.4g
C.3.2g
D.1.6g
参考答案:C
本题解析:n(O2) =" 1.12/22.4" =" 0.05mol" , 0.05mol O2反应得到0.05ⅹ4 = 0.2mol电子
得NO,NO2和O2反应共失去0.2mol电子,即Cu,Ag和HNO3反应共失去0.2mol电子(得失电子守恒),所以有:2ⅹn(Cu) + n(Ag) = 0.2mol,由质量守恒得,有:64ⅹn(Cu) + 108ⅹn(Ag) =" 14g" ,解得n(Cu) = 0.05mol,即m(Cu) = 64ⅹ0.05 =" 3.2g" 。选C
点评:本题如果利用化学方程式来求解,计算过程将会很复杂,如果利用质量守恒与得失电子守恒,将会很好的简化计算。
本题难度:简单
4、简答题 将0.1mol镁、铝合金溶于100mL2mol/L的H2SO4溶液中,然后滴加1mol/L的NaOH溶液,生成沉淀与所加NaOH溶液体积的关系如图所示.试回答下列问题:
(1)当溶液中Mg2+、Al3+恰好沉淀完全时,V(NaOH)=______mL;
(2)当V1=160mL时,金属粉末中镁的物质的量为多少?此时V2的值又是多少?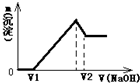
参考答案:将镁、铝合金溶于H2SO4溶液中,发生反应:Mg+H2SO4=MgSO4+H2↑;2Al+3H2SO4=Al2(SO4)3+3H2↑.0.1mol镁、铝合金,完全反应需要硫酸范围:0.1mol<n(H2SO4)<0.15mol,H2SO4有剩余(观察图象更容易得出),溶液是MgSO4、
Al2(SO4)3和H2SO4混合液.
①0--V1阶段,滴加的NaOH用于中和剩余的H2SO4,发生反应是:H2SO4+2NaOH=Na2SO4+2H2O
②V1ml时,剩余的H2SO4与滴加的NaOH恰好完全反应,溶液是MgSO4、Al2(SO4)3和Na2SO4混合液.
③V1--沉淀量最大阶段,继续滴加的NaOH与MgSO4、Al2(SO4)3反应,产生沉淀,发生反应:
Al2(SO4)3+6NaOH=2Al(OH)3↓+3Na2SO4;MgSO4+2NaOH=Mg(OH)2↓+Na2SO4
④沉淀量最大时时,MgSO4、Al2(SO4)3完全反应,沉淀达到最大值,此时,溶液是Na2SO4溶液.
⑤沉淀量最大--V2ml阶段,继续滴加的NaOH与Al(OH)3反应,沉淀量开始减少,发生反应:Al(OH)3+NaOH=NaAlO2+2H2O
⑥V2ml时,Al(OH)3完全反应,沉淀是Mg(OH)2,溶液是Na2SO4和NaAlO2混合液.
(1)当溶液中Mg2+、Al3+恰好沉淀完全时,即沉淀达到最大值,此时,溶液是Na2SO4溶液,根据SO42-离子和Na+离子守恒有:n(Na+)=2n(Na2SO4)=2n(H2SO4)=2×0.1L×2mol/L=0.4mol,所以,此时,V(NaOH)=0.4mol1mol/L=0.4L=400ml
故答案为:400;
(2)当V1=160mL时,此时,溶液是MgSO4、Al2(SO4)3和Na2SO4混合液,
由Na+离子守恒可知,n(Na2SO4)=12n(Na+)=12n(NaOH)=12×0.16L×1mol/L=0.08mol
令MgSO4为xmol,Al2(SO4)3为ymol,根据Mg原子、Al原子、SO42-离子守恒有:
本题解析:
本题难度:一般
5、选择题 甲、乙两烧杯中分别盛有10mL?1mol?L-1AlCl3溶液,在甲烧杯中加入一定量NaOH溶液;乙烧杯中加入与上述NaOH溶液等体积、等pH的氨水.下列有关两个烧杯的说法中,正确的是
A.甲中产生的沉淀一定比乙中多
B.乙中产生的沉淀一定比甲中多
C.甲和乙产生的沉淀一定一样多
D.甲和乙中产生的沉淀可能一样多
参考答案:D
本题解析:分析:根据氢氧化铝的性质,其能溶于氢氧化钠但不溶于氨水,故开始加入时,两烧杯中生成的都是氢氧化铝沉淀;
相同体积、相同pH的两溶液中的溶质一水合氨大于氢氧化钠:
当两者均不足量时,生成的沉淀氨水多;
氨水过量,氢氧化钠不足量时,生成的沉淀氨水多;
氨水过量,氢氧化钠恰好时,生成的沉淀一样多;
氨水和氢氧化钠都过量时,生成的沉淀氨水多.
解答:因氨水和NaOH溶液中,各加入10mL?0.1mol?L-1?AlCl3溶液,生成氢氧化铝沉淀,但氨水为弱电解质,部分电离,氢氧化钠为强电解质,完全电离,相同体积、相同pH的氨水和NaOH溶液中的溶质一水合氨的物质的量大于氢氧化钠的物质的量;
当两者都不足量时,生成的氢氧化铝沉淀的量由一水合氨和氢氧化钠来决定,一水合氨的物质的量大于氢氧化钠的物质的量,所以甲中沉淀比乙中的少;
?当氨水过量,氢氧化钠不足时,乙中生成的氢氧化铝的物质的量为10mL×10-3L/mL×0.1mol?L-1=0.001mol,甲中生成的氢氧化铝的物质的量小于0.001mol,所以甲中沉淀比乙中少;
当氨水过量,氢氧化钠恰好时,生成的沉淀取决于氯化铝,氯化铝的量相等,所以甲和乙中生成的沉淀一样多;
当氨水和氢氧化钠都过量时,因氢氧化铝能溶于氢氧化钠但不溶于氨水,乙中生成的氢氧化铝为0.001mol,甲中生成的氢氧化铝溶于过量的氢氧化钠,氢氧化铝沉淀小于0.001mol,所以甲中沉淀比乙中少.
通过以上分析知,甲中沉淀少于或等于乙中沉淀,故ABC错误、D正确;
故选D.
点评:本题考查了铝化合物性质、化学计算等,此题解答时,根据氢氧化铝的性质采用讨论的方法进行解答,能正确进行分段是解本题的关键,难度较大.
本题难度:一般