| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点归纳《盐类水解的原理》考点强化练习(2017年押题版)(十)
参考答案:BD 本题解析:根据电荷守恒可以判断A错误;根据电荷守恒和物料守恒可知B正确;pH=9.4说明水解大于电离,所以c(HCN) 的浓度大于c(CN-)故C错误;0.1 mol·L-1 CH3COONa 溶液与0.05 mol·L-1盐酸等体积混合后溶液中有CH3COOH为0.025mol·L-1、CH3COONa为0.025mol·L-1所以有c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)故D正确。 本题难度:困难 2、填空题 (9分)某二元酸H2A在水中的电离方程式:H2A==H++HA-;HA- |
参考答案:(1)碱性 A2-+H2O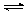 HA-+OH- (2)B、C
HA-+OH- (2)B、C
(3)c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
本题解析:(1)根据电离方程式可以看出H2A的第一步电离是完全的,第二步电离是不完全的,所以Na2A溶液可以水解呈碱性,水解方程式为A2-+H2O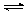 HA-+OH-。
HA-+OH-。
(2)由于H2A的第一步电离是完全的,所以溶液中不存在H2A分子,则A是正确的。根据电荷守恒c(H+)+ c(Na+)=c(OH-)+c(HA-)+2c(A2-),物料守恒c(Na+)=2c(A2-)+2c(HA-),可知c(OH-)= c(H+)+c(HA-),所以B、C错误,D正确。
(3)NaHA溶液中发生的电离反应有NaHA=Na++HA-,HA- H++A2-,HA-没有水解反应,所以溶液显酸性,溶液中的离子浓度大小关系是c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)。
H++A2-,HA-没有水解反应,所以溶液显酸性,溶液中的离子浓度大小关系是c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)。
考点:弱电解质的电离
点评:本题难度较大,主要考查学生分析问题的能力。
本题难度:困难
3、选择题 下列叙述正确的是( )
A.强电解质溶液的导电能力一定比弱电解质溶液强
B.因为醋酸是弱电解质,盐酸是强电解质,因此中和等体积等物质的量浓度的醋酸和盐酸时,中和盐酸消耗的氢氧化钠比中和醋酸多
C.物质的量浓度相同的磷酸钠和磷酸溶液中PO43
参考答案:
本题解析:
本题难度:一般
4、选择题 含有等物质的量的CH3COOH和CH3COONa的混合溶液中,下列说法正确的是
A.c(CH3COOH) + c(H+ )<c(OH-) + c(CH3COO-)
B.c(H+ ) + c(CH3COOH) = c(OH-) + c(CH3COO-)
C.c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.c(Na+) = c(CH3COOH) + c(CH3COO-)
参考答案:A
本题解析:含有等物质的量的CH3COOH和CH3COONa的混合溶液中,醋酸的电离程度大于CH3COO-的水解程度,溶液显酸性,所以选项C不正确。根据电荷守恒可知c(H+ ) + c(Na+)= c(OH-) + c(CH3COO-),由于c(Na+)>c(CH3COOH),则c(CH3COOH) + c(H+ )<c(OH-) + c(CH3COO-),A正确,B不正确。根据物料守恒可知,2c(Na+)=c(CH3COOH) + c(CH3COO-),D不正确,答案选A。
考点:考查溶液中离子浓度大小比较
点评:该题是高考中的常见题型,属于中等难度试题的考查。该题的关键是得出溶液显酸性,然后再利用好电荷守恒、物料守恒以及质子守恒即可。这些守恒法做题时需要注意体会和总结。
本题难度:困难
5、选择题 常温下下列有关CH3COONa溶液中的关系式不正确的是 ( )
A.C((H +)>1.0×10-7mol/L
B.C(CH3COOˉ) +C(OHˉ)=" C(Na" +)+C(H +)
C.C(CH3COOˉ)+C(CH3COOH) ="C(Na" +)
D.C(OHˉ)= C(CH3COOH) +C(H +)
参考答案:A
本题解析:醋酸钠为强碱弱酸盐,水解呈碱性。故A错误。B、电荷守恒,C、物料守恒,D、质子守恒。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点整理《原电池原理.. | |