微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列叙述正确的是( )
A.可能存在核外电子排布式为1s22s22p63s23p64s24p1的原子
B.当电子排布在同一能级的不同轨道时,总是优先单独占据一个轨道,而且自旋方向相反
C.1个原子轨道里最多容纳2个电子,且自旋方向相同
D.基态原子的电子获得一定能量变为激发态原子,而激发态原子变为基态原子,则要放出能量
参考答案:D
本题解析:原子轨道电子的排布依据能量最低原理,即电子总是先排在能量较低的轨道,直至此轨道排满在排下一轨道,3d轨道的能量大于4s轨道但小于4p轨道,所以电子会先排3d轨道待其排满再排4p轨道,不可能出现1s22s22p63s23p64s24p1的排列,A错;当电子排布在同一能级的不同轨道时,总是优先单独占据一个轨道,且自旋方向相同,B错误;根据泡利不相容原理1个原子轨道里最多容纳2个电子,且自旋方向应该相反,C错误;基态原子获得能量变为激发态原子。而激发态原子若要变为基态原子必须向外放出能量,D正确。
本题难度:简单
2、选择题 下列叙述正确的是
A.同一周期元素的原子,半径越小越容易失去电子
B.周期表中所有元素都是从自然界中发现的,过渡元素都是金属元素
C.非金属元素形成的共价化合物中,原子的最外层都达到8电子稳定结构
D.IA族与VIIA族元素间形成的化合物,有共价化合物也有离子化合物
参考答案:D
本题解析:A.同一周期元素的原子,半径越大越容易失去电子。错误。B.周期表中元素,有的是从自然界中发现的,有的是人工制成的元素。过渡元素都是金属元素。错误。C.非金属元素形成的共价化合物中,有的原子达到最外层2个电子的稳定结构,HCl,有的达到最外层达到8电子稳定结构,有的则未达到稳定结构。如SO2中的S。错误。D.IA族与VIIA族元素间形成的化合物,HCl是共价化合物,NaCl、KBr等是离子化合物。正确。
本题难度:简单
3、填空题 如图是元素周期表中截取的一个片段,其中X、Y、Z、W均属于短周期元素。请回答下列问题:

(1)若X单质为空气的主要成分之一,则W原子结构示意图为 。?
(2)若Y、W、Z的最高价氧化物对应的水化物依次为一元酸、二元酸、三元酸,这三种酸的正盐的含氧酸根离子中,有两种的电子数相等,则这两种离子的符号是 、 。?
(3)若Na与Y和Z的单质分别反应可以生产摩尔质量相同的两种化合物,其中Na与Y形成的化合物的电子式为 ,所含化学键的类型为 ?
(4)Y元素在周期表中可能处于第 纵行(写出所有可能纵行数)。?
参考答案:(1)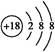 (2)SO42— PO43—
(2)SO42— PO43—
(3)Na+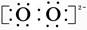 -Na+ 离子键和非极性键
-Na+ 离子键和非极性键
(4)15、16、17
本题解析:(1)根据元素周期表中的片段可知为二、三周期的右半部分,若X为空气中的主要成分之一,则X为N元素,则W为Ar元素,原子结构示意图为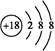 。(2)根据Y、W、Z对应的酸,可判断Y、W、Z分别为N、
。(2)根据Y、W、Z对应的酸,可判断Y、W、Z分别为N、
P、S,电子数相等的含氧酸根为SO42—、PO43—。(3)Na与Y和Z单质反应生成摩尔质量相同的两种化合物,
符合条件的Y和Z分别是O和S,Y形成的化合物为Na2O2,电子式为Na+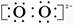 Na+,含有离子键和非极性键。(4)根据元素周期表的排列可判断Y可能处于第15、16、17纵行。
Na+,含有离子键和非极性键。(4)根据元素周期表的排列可判断Y可能处于第15、16、17纵行。
本题难度:一般
4、选择题 某元素原子的最外电子层上只有2个电子,该元素是
A.一定是IIA元素
B.一定是金属元素
C.一定是正二价元素
D.可能是 金属元素,也可能是非金属元素
参考答案:D
本题解析:元素原子的最外电子层上只有2个电子,则可以是第ⅡA元素,或He,或是过渡元素,所以答案选D。A、可能是0族;B、可能是He是非金属;C、是过渡元素时不一定是正二价,如铁,还有+3价等。
本题难度:简单
5、选择题 X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期元素,其相关信息如下表:
元素
| 相关信息
|
X
| 啤酒和饮料中常溶有X的最高价氧化物,打开瓶子时,这种氧化物会大量逸出
|
Y
| Y2是空气中含量最高的气体单质
|
Z
| Z的基态原子最外层电子排布式为2s22p4
|
W
| W的一种核素质量数为27,中子数为14
|
?
(1)W位于元素周期表第?周期第?族;Z和W的最简单的离子半径大小关系为?
?(用离子符号表示)
(2)一种X形成的单质,是自然界硬度最大的物质,若熔化这种单质,所需克服的微粒间的作用力是?;Y的电负性比Z?(填“大”或“小”)
(3)W的单质与NaOH溶液反应的离子方程式为?, W在高温条件下可还原高熔点的金属氧化物制的金属单质,写出W还原Cr2O3反应的化学方程式:?。
(4)煤燃烧产生的烟气中有Y的氧化物,会引起严重的环境问题,因此,常用XH4催化还原以消除污染,已知:
XH4(g)+2 YO2(g)="=" Y2(g)+ XO2(g)+2H2O (g) △H1= -867kJ/mol
2 YO2(g) ?Y2O4(g)?△H2=-56.9kJ/mol
?Y2O4(g)?△H2=-56.9kJ/mol
参考答案:
(1)3?ⅢA?(每空1分)? r(O2-)>r(Al3+)(1分)
(2)共价键?小(每空1分)
(3)2Al+2OH-+2H2O=2AlO2-+3H2↑(2分)? Cr2O3+2Al 2Cr+Al2O3(2分)
2Cr+Al2O3(2分)
(4)CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g)?△H=-810.1KJ/mol(2分)
本题解析:根据表格中信息,可推出X、Y、Z、W分别是C、N、O、Al。
(1)Al位于第3周期第ⅢA 族 ;半径关系为r(O2-)>r(Al3+)
(2)金刚石中的化学键为共价键;同周期从左往右,电负性增大。
(3)根据题意:2Al+2OH-+2H2O=2AlO2-+3H2↑; Cr2O3+2Al 2Cr+Al2O3
2Cr+Al2O3
(4)问根据盖斯定律,将①式减去②式即可得到答案。
本题难度:一般