微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图所示,下列表述正确的是

[? ]
A.反应的化学方程式:2M = N
B.t2时,正、逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时N的浓度是M浓度的2倍
参考答案:D
本题解析:
本题难度:简单
2、填空题 碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式。
(1)甲烷燃烧放出大量的热,可作为能源用于人类的生产和生活。
已知:①2CH4(g)+3O2(g)=2CO(g)+4H2O(l) △H=" —1214" kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H=" —566" kJ/mol
则表示甲烷燃烧热的热化学方程式 。
(2) 将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。其负极电极反应式是: 。
(3)某同学利用甲烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如下图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中正确的是 (填序号)
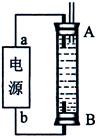
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H+ + 2e-= H2↑
(4)将不同量的CO(g)和H2O(g)分别通入体积
为2L的恒容密闭容器中,进行反应:
CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组
| 温度/℃
| 起始量/mol
| 平衡量/mol
| 达到平衡所需时间/min
|
H2O
| CO
| CO2
|
1
| 650
| 2
| 4
| 1.6
| 5
|
2
| 900
| 1
| 2
| 0.4
| 3
|
3
| 900
| 1
| 2
| 0.4
| 1
|
①实验1中,以v (H2)表示的平均反应速率为 。
②实验3跟实验2相比,改变的条件可能是 (答一种情况即可)
参考答案:(1)CH4(g)+2O2(g) CO2(g)+2H2O(l) △H1=—890KJ.mol-1
CO2(g)+2H2O(l) △H1=—890KJ.mol-1
(2)CH4-8e-+ 10 OH- CO32-+ 7H2O;
CO32-+ 7H2O;
(3) B、D ;
(4)① 0.16mol/(L·min) ②使用了催化剂;加大了压强(任答一种)
本题解析:(1)甲烷完全燃烧生成二氧化碳气体和液态水,所以甲烷燃烧热的热化学方程式中甲烷的物质的量是1mol,将①②相加除以2可得,答案是CH4(g)+2O2(g) CO2(g)+2H2O(l) △H1=—890KJ.mol-1
CO2(g)+2H2O(l) △H1=—890KJ.mol-1
(2)负极发生氧化反应,所以甲烷在负极发生氧化反应,结合电解质溶液,负极的电极反应式为CH4- 8e-+ 10 OH- CO32-+ 7H2O;
CO32-+ 7H2O;
(3)A、电解过程中两极分别是H+和Fe放电生成氢气和亚铁离子,所以两极哪端都可以生成氢气,a不一定为正极,b不一定为负极,但a为正极,b为负极,效果较好,错误;B、在装置中铁一定作阳极,所以氯化钠溶液是电解质溶液,不影响阳极Fe放电生成亚铁离子,阴极H+放电生成氢气,正确;C、装置中铁一定作阳极,阴极可以是铁,也可以是其他惰性电极,错误;D、阴极H+放电生成氢气,正确,答案选BD。
(4)①实验1中,CO2的浓度增加0.8mol/L,所以氢气浓度也增加0.8mol/L,v (H2)= 0.8mol/L/5min=0.16mol/(L·min);
②实验3跟实验2相比,到达平衡时间缩短,说明反应速率加快,反应温度、各物质的物质的量均未变,所以可能是使用了催化剂或增大压强。
考点:考查盖斯定律得应用,电化学理论的应用,反应速率的计算及条件对反应速率的影响判断
本题难度:困难
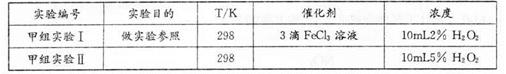
3、实验题 现甲、乙两化学小组安装两套如下相同装置,用以探究影响H2O2分解速率的因素。

(1)仪器a的名称______;检查装置气密性的操作为______。
(2)MnO2催化下H2O2分解的化学方程式是______。
(3)甲小组有如下实验设计方案,请帮助完成(所有空均需填满)。
⑷甲、乙两小组得出如图数据。
①由甲组实验II得出的数据可知:浓度越大,H2O2分解速率______;
②由乙组研究的酸、碱对H2O2分解影响因素的 数据分析:相同条件下,Na2O2和K2O2溶于水放出气体速率较快的是______;乙组提出可以用BaO2固体与H2SO4溶液反应制H2O2,其化学反应方程式为______;支持这一方案的理由是____________。

参考答案:(14分)(1)锥形瓶(1分)将注射器活塞固定,向分液漏斗中注入适量蒸馏水,打开分液漏斗活塞,如果分流漏斗颈部能形成稳定的水柱,说明装置气密性良好,反之则气密性差。(或关闭分液漏斗活塞,加热锥形瓶,如果注射器活塞外移,停止加热后注射器活塞回到原来位置,则说明气密性良好,反之则气密性差。或关闭分液漏斗活塞,用力将注射器活塞外移,停止用力后注射器活塞回到原来位置,则说明气密性良好,反之则气密性差。)(2分其他合理答案也给分)(2)2H2O2 2H2O+O2↑(2分)(3)
2H2O+O2↑(2分)(3)
?
探究浓度对速率的影响
?
3滴FeCl3溶液
?
?
(各1分,共2分)(4)①越快(1分)②K2O2(2分)BaO2+H2SO4=BaSO4↓+H2O2(2分)制备H2O2的环境为酸性环境,H2O2分解速率较慢(2分)
本题解析:(1)检查装置气密性可用加水法或加热法或抽气法。
(3)实验I和IIH2O2浓度不同,实验目的是探究浓度对速率的影响,所以II也只能加3滴氯化铁溶液。
(4)①由图像可看出甲组实验II斜率大,完全放出氧气所用时间少,反应速率快,所以过氧化氢浓度越大,反应速率越快。②碱性条件下过氧化氢分解速率比酸性条件下过氧化氢分解速率快,过氧化钾溶于水生成的KOH比过氧化钠溶于水生成的氢氧化钠碱性强,过氧化钠和过氧化钾溶于水放出氧气速率较快的是过氧化钾;过氧化钡与硫酸生成硫酸钡和过氧化氢,酸性条件下过氧化氢分解速率较慢,可以用该反应制备过氧化氢。
本题难度:一般
4、选择题 下列实验中,反应速率加快是由催化剂引起的是( )
A.在炭粉中加入KCl03,点燃时燃烧更为剧烈
B.将炭块粉碎成粉末状,可使燃烧更加充分
C.H2O2中加入少量MnO2,即可迅速放出气体
D.电解水时,加少量硫酸可使电解速率加快
参考答案:A.在炭粉中加入氯酸钾,氯酸钾分解生成氧气,促进燃烧,点燃时燃烧更为剧烈,与催化剂无关,故A错误;
B.炭块粉碎成粉末状,固体表面积增大,反应速率增大,与催化剂无关,故B错误;
C.在双氧水的分解反应中,二氧化锰起到催化剂的作用,故C正确;
D.用锌与稀硫酸反应制备氢气时,加入少量浓硫酸,氢离子浓度增大,反应速率增大,与催化剂无关,故D错误.
故选C.
本题解析:
本题难度:简单
5、选择题 将等质量的a、b两份锌粉装入试管中,分别加入过量的稀硫酸,同时向装a的试管中加入少量CuSO4溶液。右图表示产生氢气的体积V与时间t的关系,其中正确的是(?)
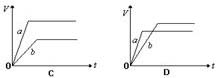
参考答案:D
本题解析:向装a的试管中加入少量CuSO4溶液,则锌和硫酸铜发生置换反应,生成铜,则可以构成原电池,锌是负极,加快反应速率。但由于消耗了部分锌,则生成的氢气减少,答案选D。
点评:该题是高考中的常见题型,属于中等难度的试题。试题设计新颖,综合性强,侧重对学生解题能力和技巧的培养和训练,有利于培养学生的逻辑推理能力和发散思维能力,提高学生的应试能力和学习效率。该题的关键是明确原电池原理,并能结合题意灵活运用即可。
本题难度:简单