微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 常温下,对于1L0.005mol·L-1硫酸表述中正确的是
A.由水电离出的 c(H+)=1.0×10-12mol·L-1
B.加水稀释后,溶液中所有离子的浓度均减少
C.2c(H+)= c(SO42-)+ c(OH-)
D.滴加稀氨水使pH=7,则c(NH4+)=" 2" c(SO42-)
参考答案:AD
本题解析:硫酸是强酸,能完全电离,则H2SO4=2H++SO42—中氢离子浓度与硫酸浓度之比等于系数之比,即c(H+)=0.005mol·L-1×2 =0.01mol/L,由于水是极弱电解质,硫酸能抑制水的电离,水电离出的氢离子可忽略不计,则溶液中c(H+)=0.01mol/L,由于常温下水的离子积为1.0×10-14,则溶液中c(OH-)=Kw/ c(H+)=1.0×10-12 mol/L,由于溶质不能电离出氢氧根离子,氢氧根离子全部来自水的电离,则水电离出c(OH-)= 1.0×10-12 mol/L,由于H2O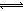 H++OH—中氢离子和氢氧根离子的浓度之比等于系数之比,则由水电离出的c(H+)=1.0×10-12mol·L-1,故A正确;硫酸溶液呈酸性,加水稀释后,酸性减弱,氢离子、硫酸根离子浓度均减小,但温度不变水的离子积不变,即溶液中氢离子浓度与氢氧根离子浓度的乘积不变,所以溶液中氢氧根离子浓度一定增大,故B错;硫酸溶液中含有氢离子、硫酸根离子和氢氧根离子,根据电荷守恒原理可得:c(H+)="2" c(SO42-)+ c(OH-),故C错;无论量的多少,稀硫酸与氨水混合后溶液只有铵根离子、氢离子、硫酸根离子和氢氧根离子,根据电荷守恒规律可得:c(NH4+)+c(H+)="2" c(SO42-)+ c(OH-),由于滴加稀氨水使pH=7,则该溶液中c(NH4+)="2" c(SO42-),故D正确。
H++OH—中氢离子和氢氧根离子的浓度之比等于系数之比,则由水电离出的c(H+)=1.0×10-12mol·L-1,故A正确;硫酸溶液呈酸性,加水稀释后,酸性减弱,氢离子、硫酸根离子浓度均减小,但温度不变水的离子积不变,即溶液中氢离子浓度与氢氧根离子浓度的乘积不变,所以溶液中氢氧根离子浓度一定增大,故B错;硫酸溶液中含有氢离子、硫酸根离子和氢氧根离子,根据电荷守恒原理可得:c(H+)="2" c(SO42-)+ c(OH-),故C错;无论量的多少,稀硫酸与氨水混合后溶液只有铵根离子、氢离子、硫酸根离子和氢氧根离子,根据电荷守恒规律可得:c(NH4+)+c(H+)="2" c(SO42-)+ c(OH-),由于滴加稀氨水使pH=7,则该溶液中c(NH4+)="2" c(SO42-),故D正确。
本题难度:一般
2、选择题 95℃时某溶液的pH=6,对该溶液的判断正确的是
A.呈酸性
B.c(H+)=1×10-6mol/L
C.c(OH-)=1×10-6mol/L
D.无法判断
参考答案:B
本题解析:考查pH的概念和溶液酸碱性的判断。溶液中氢离子浓度的负对数称为溶液的pH。pH=6,所以氢离子的浓度是1×10-6mol/。由于无法确定该温度下的水的离子积常数,所以溶液的酸碱性无法确定。答案选B。
本题难度:一般
3、选择题 pH=11的X、Y两种碱溶液各10mL,分别稀释至1000mL。其pH与溶液体积(V)的关系如图所示,下列说法正确的是(?)

A.X、Y两种碱的物质的量浓度一定相等
B.稀释后,X溶液碱性比Y溶液碱性强
C.若9<a<11,则X、Y都是弱碱
D.完全中和X、Y两溶液时,消耗同浓度盐酸的体积VX>VY
参考答案:C
本题解析:由于稀释可以促进弱电解质的电离,所以对于pH相等的碱溶液,相对弱的碱的pH减小的幅度要小,即酸Y较弱;均稀释到1L时,Y的碱性略强。
由图知两种碱的碱性强弱Y<X,所以pH=11时的两溶液,由c(H+)=c·α公式可知,两碱的物质的量浓度一定不相等;但Y是不是强碱,也不能肯定,如果a=9,则可肯定X为强碱,否则为弱碱
D:由Y的碱性较弱,再由c(H+)=c·α可知Y的c较大,,其物质的量较大,中和时耗盐酸较多
本题难度:一般
4、选择题 下列四种溶液①pH=0的盐酸②0.1 kJ·mol-1的盐酸③0.01 kJ·mol-1的NaOH溶液?④pH=11的NaOH溶液由水电离出的氢离子浓度之比为
A.1∶10∶100∶1000
B.0∶1∶12∶11
C.14∶13∶12∶11
D.14∶13∶2∶3
参考答案:A
本题解析:①pH=0的盐酸由水电离出的氢浓度为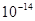 ,②0.1 kJ·mol-1的盐酸由水电离出的氢浓度为
,②0.1 kJ·mol-1的盐酸由水电离出的氢浓度为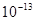 ,③0.01 kJ·mol-1的NaOH溶液由水电离出的氢浓度为
,③0.01 kJ·mol-1的NaOH溶液由水电离出的氢浓度为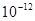 ,④pH=11的NaOH溶液由水电离出的氢离子浓度为
,④pH=11的NaOH溶液由水电离出的氢离子浓度为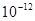 ,所以正确选项为A;
,所以正确选项为A;
本题难度:一般
5、实验题 用中和滴定法测定某烧碱样品的纯度。有以下步骤:
(1)配制待测液:用5.0g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制1000mL溶液。除烧杯和玻棒外,还需要的玻璃仪器有___________________________.
(2)滴定:①盛装0.1000 mol/L的盐酸标准液应该使用_______式滴定管。
②滴定时双眼应_________________________________________________.
(3)有关数据记录如下:
测定序号
| 待测溶液的体积(mL)
| 所耗盐酸标准液的体积(mL)
|
滴定前读数
| 滴定后读数
|
1
| 20.00
| 0.50
| 20.78
|
2
| 20.00
| 1.20
| 21.32
|
计算纯度:烧碱样品的纯度是__________________;
(取两次实验所耗盐酸的平均值进行计算)
(4)误差讨论:(选填“偏高”、“偏低”或“无影响” )
① 用蒸馏水冲洗锥形瓶,会使测定结果____________;
② 在滴定过程中不慎将数滴酸液滴在锥形瓶外,会使测定结果____________;
③ 读数时,滴定前仰视,滴定后俯视,会使测定结果____________;
④ 装标准液之前,没有用标准液润洗滴定管,会使测定结果____________。
参考答案:(1)1000mL容量瓶 (2)① 酸② 观察锥形瓶中溶液颜色的变化(3)80.8% (4)① 无影响 ② 偏高 ③ 偏低 ④ 偏高
本题解析:(1) 配制1000mL一定物质的量浓度的氢氧化钠溶液需要仪器:1000mL容量瓶、胶头滴管、烧杯、玻璃棒、量筒、天平等;(2)盐酸应用酸式滴定管盛放;滴定时眼睛注视锥形瓶中颜色变化;(3)消耗盐酸体积平均为20.20mL,0.1000 mol/L ×20.20mL×10-3=20.00mL×10-3×c(NaOH),c(NaOH)=0.101mol/L。所以烧碱的纯度为0.101×1×40g/5g=0.808。 (4)用蒸馏水冲洗锥形瓶对测定结果无影响;滴定过程中不慎将酸滴在瓶外使盐酸消耗的体积偏多,测定结果偏大;滴定前仰视、滴定后俯视,盐酸体积偏小,测定结果偏小;未用标准液润洗滴定管,消耗盐酸体积偏大,测定结果偏高。
点评:酸碱中和滴定时,左手控制活塞或玻璃小球、右手摇动锥形瓶、眼睛注视锥形瓶中颜色变化。
本题难度:一般