微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列可逆反应达平衡后,改变反应条件,其变化趋势正确的是

参考答案:D
本题解析:A、醋酸是弱酸,存在电离平衡CH3COOH CH3COO-+H+,加入醋酸钠固体,增大溶液中的CH3COO-浓度,乙醇醋酸的电离,所以溶液的酸性降低,pG增大,A不正确;B、根据离子方程式Fe3++3SCN-=Fe(SCN)3可知,氯离子和钾离子并不参与反应,所以加入氯化钾固体后平衡并不,因此铁离子的浓度不变,B不正确;C、在恒温恒压下充入Ar,则容器的容积增大,物质的浓度降低,所以合成氨反应向逆反应方向移动,反应物的转化率降低,C不正确;D、该反应的正方应是吸热反应,升高温度平衡向正反应方向移动,因此反应物的转化率增大,D正确,答案选D。
CH3COO-+H+,加入醋酸钠固体,增大溶液中的CH3COO-浓度,乙醇醋酸的电离,所以溶液的酸性降低,pG增大,A不正确;B、根据离子方程式Fe3++3SCN-=Fe(SCN)3可知,氯离子和钾离子并不参与反应,所以加入氯化钾固体后平衡并不,因此铁离子的浓度不变,B不正确;C、在恒温恒压下充入Ar,则容器的容积增大,物质的浓度降低,所以合成氨反应向逆反应方向移动,反应物的转化率降低,C不正确;D、该反应的正方应是吸热反应,升高温度平衡向正反应方向移动,因此反应物的转化率增大,D正确,答案选D。
本题难度:一般
2、选择题 某温度下,在一密闭容器中发生如下可逆反应:2E(g)  F(g)+xG(g);△H<0。若起始时E浓度为a mol·L-1,F、G浓度均为0,达平衡时E浓度为0.5a mol·L-1;若E的起始浓度改为 2a mol·L-1,F、G浓度仍为0,当达到新的平衡时,下列说法正确的是?
F(g)+xG(g);△H<0。若起始时E浓度为a mol·L-1,F、G浓度均为0,达平衡时E浓度为0.5a mol·L-1;若E的起始浓度改为 2a mol·L-1,F、G浓度仍为0,当达到新的平衡时,下列说法正确的是?
A.升高温度时,正反应速率加快、逆反应速率减慢
B.若x=l,容器体积保持不变,新平衡下E的体积分数为50%
C.若x=2,容器体积保持不变,新平衡下F的平衡浓度大于0.5a mol·L-1
D.若x=2,容器压强保持不变,新平衡下E的物质的量为a mol
参考答案:B
本题解析:略
本题难度:简单
3、选择题 已知反应3X(g)+Y(g) 2Z(g)? ΔH>0,T℃时化学平衡常数K = 2,在密闭容器中反应达到平衡,下列说法正确的是(?)
2Z(g)? ΔH>0,T℃时化学平衡常数K = 2,在密闭容器中反应达到平衡,下列说法正确的是(?)
A.升高温度平衡常数K减小
B.若压缩体积,平衡向气体体积增大方向移动,混合气体的平均相对分子质量减小
C.保持体积不变,通入稀有气体,压强增大,平衡向正反应方向移动
D.T℃时,向2L密闭容器中加入 2molX、3molY、4molZ,反应将向左进行
参考答案:D
本题解析:考查条件变化对化学平衡反应的影响。ΔH>0,该反应为吸热反应,升高温度,平衡向正反应方向(吸热)移动,K增大,A错误;压缩体积,压强增大,平衡向气体体积减小的方向移动(正方向),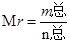 ,根据质量守恒定律,m总不变,n总减小,Mr增大,B错误;保持体积不变,温度不变,通入稀有气体,压强增大,但反应气体产生的分压不变,即反应物和生成物的浓度不变,不影响化学反应速率,正负反应速率仍相等,平衡不移动,C错误;
,根据质量守恒定律,m总不变,n总减小,Mr增大,B错误;保持体积不变,温度不变,通入稀有气体,压强增大,但反应气体产生的分压不变,即反应物和生成物的浓度不变,不影响化学反应速率,正负反应速率仍相等,平衡不移动,C错误;
本题难度:简单
4、计算题 反应SO2(g)+ NO2(g)  SO3(g)+NO(g) ,若在一定温度下,将物质的量浓度均为2mol/L的SO2(g)和NO2(g)注入一密闭容器中,当达到平衡状态时,测得容器中SO2(g)的转化率为50%,试求:在该温度下。
SO3(g)+NO(g) ,若在一定温度下,将物质的量浓度均为2mol/L的SO2(g)和NO2(g)注入一密闭容器中,当达到平衡状态时,测得容器中SO2(g)的转化率为50%,试求:在该温度下。
(1)此反应的平 衡常数。
衡常数。
(2)若SO2(g)的初始浓度增大到3mol/L, NO2(g)的初始浓度仍为2mol/L,则SO2(g)、NO2(g)的转化率变为多少?
参考答案:K=1(4分)转化率40%,60%(4分)
本题解析:略
本题难度:一般
5、选择题 在容积一定的密闭容器中发生可逆反应:A(g)+2B(g) 2C(g)? ΔH>0,其他条件不变化,只有温度变化时,某量随温度变化的关系如图所示。则下列说法中,正确的是
2C(g)? ΔH>0,其他条件不变化,只有温度变化时,某量随温度变化的关系如图所示。则下列说法中,正确的是

A.若P1>P2,纵坐标表示A的质量分数
B.若P1<P2,纵坐标表示C的质量分数
C.若P1>P2,纵坐标表示混合气体的平均摩尔质量
D.若P1<P2,纵坐标表示A的转化率
参考答案:C
本题解析:根据方程式可知,该反应是体积减小的吸热的可逆反应。A、在压强不变的条件下,升高温度平衡向正反应方向移动,A的质量分数减小。A不正确;B、在压强不变的条件下,升高温度平衡向正反应方向移动,C的质量分数增大。在温度不变的条件下,增大压强平衡向正反应方向移动,C的质量分数增大。因此如果纵坐标表示C的质量分数,则压强应该是P1>P2,B不正确;C、混合气的平均摩尔质量是混合气的质量与混合气总物质的量的比值,在温度不变的条件下,增大压强平衡向正反应方向移动,气体的物质的量减小,质量不变,因此平均摩尔质量增大。压强不变时,升高温度平衡向正反应方向移动,气体的物质的量减小,质量不变,因此平均摩尔质量增大。所以纵坐标表示混合气体的平均摩尔质量,则压强应该是P1>P2,C正确;D、在压强不变的条件下,升高温度平衡向正反应方向移动,A的转化率增大。在温度不变的条件下,增大压强平衡向正反应方向移动,A的转化率增大。所以如果纵坐标表示A的转化率,则压强应该是P1>P2,D不正确,答案选C。
本题难度:一般