微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 同温度下,体积均为1L的两个恒容密闭容器中发生可逆反应:
N2(g)+3H2(g)  2NH3(g)?△H=" -92.6kJ/mol." 测得数据如下表
2NH3(g)?△H=" -92.6kJ/mol." 测得数据如下表
容器编号
| 起始时各物质物质的量/mol
| 达到平衡时体系能量的变化
|
N2
| H2
| NH3
|
(1)
| 2
| 3
| 0
| 27.78kJ
|
(2)
| 1.6
| 1.8
| 0.8
| Q
|
?
下列叙述不正确的是
A.容器(1)(2)反应达平衡时压强相等
B.容器(2)中反应开始时v(正)>v(逆)
C.容器(2)中反应达平衡时,吸收的热量Q为9.26kJ
D.若条件为“绝热恒容”,容器(1)中反应达平衡时n(NH3)<0.6mol
2、计算题 在25℃时,向100mL含氯化氢14.6g的盐酸溶液里放入5.6g纯铁粉(不考虑反应前后溶液的体积变化),反应开始至2min时收集到氢气1.12L(标准状况),在此之后又经过4min,铁粉完全溶解。问:
(1)在前2min内,用FeCl2表示的平均反应速率是多少?
(2)在后4min内,用盐酸表示的平均反应速率是多少?
(3)前2min和后4min相比,反应速率哪个较快?为什么?
3、选择题 在已经处于化学平衡状态的体系中,如果下列量发生变化,其中一定能表明平衡移动的是(?)
?
A.反应混和物的浓度
B.正、逆反应速率
C.反应混和物的压强
D.反应混合物中各物质的百分含量
4、选择题 如图所示,向A、B中均充入1molX、l rnol Y,起始时A、B的体积都等于aL。在相同温度、外界压强和催化剂存在的条件下,关闭活塞K,使两容器中都发生下述反应:
X(g)+Y(g)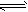 2Z(g)+W(g) △H<0,达平衡时,A的体积为1.4aL。下列说法错误的是
2Z(g)+W(g) △H<0,达平衡时,A的体积为1.4aL。下列说法错误的是
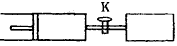
[? ]
A.反应速率:v(B)>v(A)
B.A容器中x的转化率为80%
C.平衡时的平均摩尔质量:
D.平衡时Y体积分数:A<B
5、简答题 (本题共12分)
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
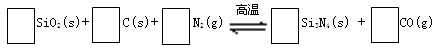
29.配平反应中各物质的化学计量数,并标明电子转移方向和数目。
30.该反应的氧化剂是?,其还原产物是?。
31.上述反应进程中能量变化示意图如下,试在图像中用虚线表示在反应中使用催化剂后能量的变化情况。
 ?
?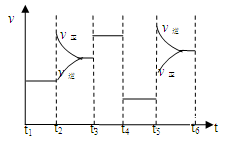
32.该反应的平衡常数表达式为K=?。升高温度,其平衡常数?(选填“增大”、“减小”或“不变”)。
33.该化学反应速率与反应时间的关系如上图所示,t2时引起v正突变、v逆 渐变的原因 是?
?,t3引起变化的因素为?,t5时引起v逆大变化、v正小变化的原因是?。