微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在一个不导热的恒容密闭容器中通入CO(g)和H2O(g),一定条件下使反应CO(g)+H2O(g) CO2(g)+H2(g)达到平衡状态,正反应速率随时间变化的示意图如下所示。由图可得出的正确结论是
CO2(g)+H2(g)达到平衡状态,正反应速率随时间变化的示意图如下所示。由图可得出的正确结论是

A.反应物浓度:a点小于c点
B.c点时反应进行的程度最大
C.该反应的正反应为吸热反应
D.△t1=△t2时,生成H2的物质的量:a~b段小于b~c段
参考答案:D
本题解析:反应起始时反应物浓度大,因此反应物浓度:a点大于c点,A项错;c点反应速率最大,反应不一定处于平衡态,而反应进行程度最大是指反应达到平衡态,B项错;反应起始阶段,反应物浓度减少而反应速率加快,只能是温度升高导致,再结合容器不导热可知正反应为放热反应,C项错;反应速率a~b小于b~c,故等同时间内,生成H2的量,a~b段小于b~c段,D项正确。
本题难度:一般
2、填空题 反应aA(g)+bB(g) cC(g)(
cC(g)( H<0)在等容条件下进行。改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如下图所示:
H<0)在等容条件下进行。改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如下图所示:

回答问题:
(1)反应的化学方程式中,a:b:c为?;
(2)A的平均反应速率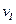 (A)、
(A)、 (A)、
(A)、 (A)从大到小排列次序为?;
(A)从大到小排列次序为?;
(3)B的平衡转化率 中最小的是?,其值是?;
中最小的是?,其值是?;
(4)由第一次平衡到第二次平衡,平衡移动的方向是?,采取的措施是?;
(5)比较第II阶段反应温度(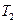 )和第III阶段反应速度(
)和第III阶段反应速度(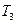 )的高低:
)的高低: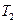 ?
?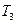
填“>、=、<”判断的理由是?;
(6)达到第三次平衡后,将容器的体积扩大一倍,假定10min后达到新的平衡,请在下图中用曲线表示IV阶段体系中各物质的浓度随时间变化的趋势(曲线上必须标出A、B、C).
参考答案:
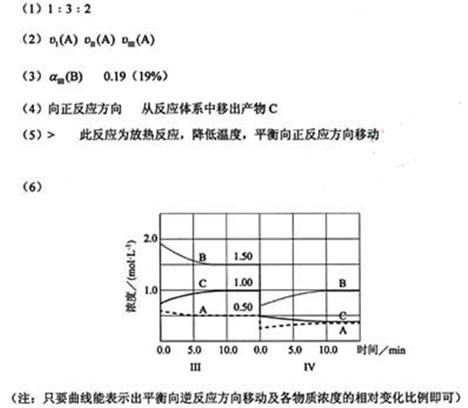
本题解析:略
本题难度:一般
3、选择题 将 4 mol A 气体和 2 mol B 气体在 2 L 的容器中混合并在一定条件下发生如下反应2A(g)+B(g) 2C(g)若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1 ,现有下列几种说法:
2C(g)若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1 ,现有下列几种说法:
① 用物质 A 表示的反应的平均速率为 0.3 mol·(L·s)-1
② 用物质 B 表示的反应的平均速率为 0.6 mol·(L·s)-1
③ 2 s 时物质 A 和 B 的转化率(发生反应的物质的量占总物质的量的百分数)一样
④ 2 s 时物质 B 的浓度为 0.3 mol·L-1?
其中正确的是
A.①③
B.③④
C.②③
D.①④
参考答案:A
本题解析:略
本题难度:简单
4、选择题 某容积可变的密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:A(g)+B(g) 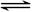 2C(g)+Q(Q>0),容器中物质浓度随时间变化的曲线如图所示。下列说法中正确的是
2C(g)+Q(Q>0),容器中物质浓度随时间变化的曲线如图所示。下列说法中正确的是
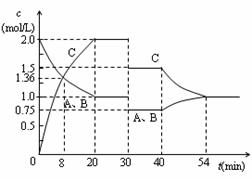
A.30min时降低温度,40min时升高温度
B.40min~54min之间反应速率v(正) < v(逆)
C.设20min和30min时的平衡常数分别为K1和K2,则K1 >K2
D.0~8minA的平均反应速率为0.64mol/(L·min)
参考答案:B
本题解析:A、由图象知,降低温度平衡向正反应方向移动,平衡时C的量应该增加与图像不符,故A错误;B、该时间段平衡应该逆向移动,应该是v(正) < v(逆),故B正确;C.则K1 <K2故C错误.D、0~8minA的平均反应速率为(2-1.36)/8=0.08mol/(L·min),故D错误.故选B.
本题难度:一般
5、填空题 已知工业上合成氨的反应为:N2(g)+3H2(g) 2NH3(g) △H<0。在一体积为2L的密闭容积中,加入0.20mol的N2和0.60mol的H2,反应中NH3的物质的量浓度的变化情况如图所示,
2NH3(g) △H<0。在一体积为2L的密闭容积中,加入0.20mol的N2和0.60mol的H2,反应中NH3的物质的量浓度的变化情况如图所示,
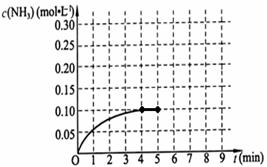
请回答下列问题:
(1) 写出该反应平衡常数的表达式K="_____"
(2)反应进行到4分钟到达平衡。请计算从反应开始到刚刚平衡,平均反应速率v(NH3)?为?;
(3)5分钟时,保持其它条件不变,把容器的体积缩小一半,平衡?移动(填“向逆反应方向”、“向正反应方向”或“不”)。化学平衡常数将?(填“增大”、“减少”或“不变”)。
(4)N2和H2的反应还有其它应用。如:有人设想寻求合适的催化剂和电极材料,分别以N2、H2为电极反应物,以HCl—NH4Cl溶液为电解质溶液制造新型燃料电池,试写出该电池的正极电极反应式?。
参考答案:(1)? K=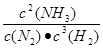 ;(2)? 0.025mol.L-1.min-1?
;(2)? 0.025mol.L-1.min-1?
(3)?正反应方向?不变?(4)N2+6e-+8H+=2NH4+
本题解析:(1)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据方程式可知,该反应的平衡常数表达式K=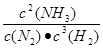 。
。
(2)根据图像可知,在反应进行到4分钟时,生成氨气的物质的量浓度是0.10mol/L,则用氨气表示的反应速率是0.10mol/L÷4min=0.025mol.L-1.min-1。
(3)5分钟时,保持其它条件不变,把容器的体积缩小一半,则压强增大,平衡向正反应方向移动。平衡常数只与温度有关系,所以该反应的平衡常数不变。
(4)原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。所以氢气在负极通入,氮气在正极通入,则正极电极反应式是N2+6e-+8H+=2NH4+。
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,在注重对学生基础知识的巩固和训练的同时,侧重对学生能力的培养和方法的指导与训练,有利于培养学生的逻辑推理能力和抽象思维能力。
本题难度:困难