微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 除去下列各组物质中的杂质(括号内为杂质)时,按如下步骤进行操作:
①加入过量稀硫酸
②加入适量的氢氧化钾溶液
③蒸发、结晶,能达到实验目的的是
A.K2SO4(K2CO3)
B.铁粉(Fe2O3)
C.NaCl(Na2CO3)
D.银粉(铜粉)
参考答案:A
本题解析:
本题难度:困难
2、推断题 短周期元素甲、乙、丙、丁、戊在元素周期表中的位置如表所示,其中丁所处的主族序数是其周期序数的三倍。回答下列问题:
(1)甲在元素周期表中的位置是?。
(2)原子半径:甲?丁(填“>”或“<”)。
(3)乙与戊组成化合物的电子式为?,其中化学键的类型是?(填“极性”或“非极性”)共价键。
(4)元素的非金属性:甲?丙(填“>”或“<”),下列事实能说明该结论的是?。
A、丙的氢化物稳定,甲的氢化物不稳定
B、丙的最高价氧化物对应的水化物是强酸,甲的是弱酸
C、丙的最高价氧化物对应的水化物易溶于水,甲的难溶
(5)丙的单质的电子式为?,乙与丁的原子构成的三原子分子的电子式为?。
参考答案:(1)第三周期第ⅣA族?(2)>?(3)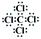 ?极性
?极性
(4)<? A B
(5) ?
?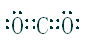
本题解析:丁所处的主族序数是其周期序数的三倍,所以丁只能是O,甲、乙、丙、戊分别为Si、C、N、Cl,(1)甲为Si,其在元素周期表中的位置是第三周期第ⅣA族;(2)根据同一周期,原子半径从左往右缩小,可知甲>丁;(3)乙与戊组成化合物为CCl4,其电子式为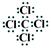 ;化学键的类型为极性共价键;(4)甲为Si,丙为N,所以非金属性是甲<丙,能说明该结论是因为一、丙的氢化物稳定,甲的氢化物不稳定;二、丙的最高价氧化物对应的水化物是强酸,甲的是弱酸,所以答案为 A B。(5)丙的单质为氮气,其电子式为
;化学键的类型为极性共价键;(4)甲为Si,丙为N,所以非金属性是甲<丙,能说明该结论是因为一、丙的氢化物稳定,甲的氢化物不稳定;二、丙的最高价氧化物对应的水化物是强酸,甲的是弱酸,所以答案为 A B。(5)丙的单质为氮气,其电子式为 ;乙与丁的原子构成的三原子分子为二氧化碳,其电子式为
;乙与丁的原子构成的三原子分子为二氧化碳,其电子式为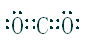 。
。
点评:本题考查了元素周期表,元素性质,是高考的考查重点,该题关键是根据丁所处的主族序数是其周期序数的三倍,推断出丁为O,从而推断出其他,该题难度不大。
本题难度:一般
3、填空题 (6分)A、B、C和D等4种元素,A元素所处的周期数、主族序数、原子序数均相等;B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层少2个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C。
(1)B在周期表中的位置第?周期,第?族;
(2)A、B形成的化合物的电子式?;
(3)C的元素名称___?_____,C的最高价氧化物的化学式?;
(4) D的最高价氧化物对应的水化物的化学式?。
参考答案:(6分)(每空1分)
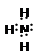 (1)第?三?周期,第? VA?族;
(1)第?三?周期,第? VA?族;
(2)?;?(3) 硫, SO3;(4) KOH
本题解析:
A是氢,HBO3最高正价是+5价,原子半径是其所在主族中最小的,B是氮,C元素原子的最外层电子数比次外层少2个,C是硫,由D2C得D为+1价,是K;A、B、C和D 4种元素分别为H、N、S、K。
(1)N在第三周期,第 VA族;
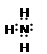 (2)NH3的电子式为?;?(3) 硫, SO3;(4) KOH
(2)NH3的电子式为?;?(3) 硫, SO3;(4) KOH
本题难度:一般
4、选择题 19世纪中叶,门捷列夫的突出贡献是(?)
A.提出原子学说
B.发现元素周期律
C.提出分子学说
D.提出电离学说
参考答案:B
本题解析:A、道尔顿提出了近代原子学说,错误;B、1869年,俄国化学家门捷列夫发现了元素周期律,正确;C、阿佛加德罗提出了分子学说,错误;D、阿伦尼乌斯提出电离学说,错误,答案选B。
本题难度:简单
5、选择题 39号元素钇的电子排布式应是下列排布中的哪一种
A.1s22s22p63s23p63d104s24p64d15s2
B.1s22s22p63s23p63d104s24p65s25p1
C.1s22s22p63s23p63d104s24p64f15s2
D.1s22s22p63s23p63d104s24p65s25d1
参考答案:A
本题解析:根据构造原理可知,选项A正确;
本题难度:一般