微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 钾(K)与Na在性质上具有很大的相似性,但K比Na的活泼性强,下面是根据Na的性质对K的性质的预测,其中正确的是( )
A.K是银白色金属,硬度大,熔点高
B.K在空气可以被空气中的氧气所氧化,且产物只有K2O
C.K与水能够反应,但不如Na与水的反应剧烈,产物都有氢气
D.K也可以与氯气反应,且比Na与氯气的反应剧烈
参考答案:D
本题解析:锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)等元素称为碱金属。由于它们的原子最外层电子数都是1,都容易失去最外层的1个电子,因此,在性质上有相似性。但随着电子层数的增加,原子核对外层电子的吸引力逐渐减弱,失去电子的能力增强,因此,它们的金属活动性逐渐增强。碱金属单质的硬度都很小,熔点都较低,故A错误;由于K的活动性比Na更强,更容易与O2、Cl2、H2O等反应,故B、C错误,D正确。
本题难度:一般
2、选择题 X元素原子的L层比Y元素原子的L层少3个电子,X元素原子的核外电子总数比Y元素原子的核外电子总数少5个,则X、Y可形成的化合物是(?)
A.离子化合物Y(XO3)2
B.离子化合物Y2X3
C.共价化合物XY2
D.共价化合物Y3X2
参考答案:A
本题解析:L层最多只能容纳8个电子,X元素原子的L层比Y元素原子的L层少3个电子,而X元素原子的核外电子总比Y元素原子核外电子总数少5个,因此X元素原子核外比Y元素原子核外除少L层3个电子外,还少M层2个电子,所以X是N元素,Y是Mg元素,可形成离子化合物Mg(NO3)2和Mg3N2,因此只有A项正确。
本题难度:简单
3、填空题 A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A、C及B、D分别是同一主族元素,B、D两元素的原子核中质子数之和是A、C两元素原子核中质子数之和的两倍,又知四种元素的单质中有两种气体、两种固体。
(1) A??;D?(填元素名称)
(2)写出C、D两元素形成的常见化合物的电子式?;写出由A、B两元素形成的18电子微粒中所含化学键类型?。
(3)用A元素的单质与B元素的单质可以制成电池,电池中装有KOH浓溶液,用多孔的金属惰性电极浸入KOH溶液,两极均有特制的防止气体透过的隔膜。在一极通人A的单质,另一极通人B的单质,写出该电池发生的电极反应式:
通入A单质的一极:?;
通入B单质的一极:?。?
(4)由A、B、C 三元素构成的化合物X,常在试验制备过程中起尾气吸收作用。请写出化合物X吸收NO2 时所发生反应的离子方程式:??。
参考答案:(1) 氢?;硫(各1分)?
(2)??;(2分);极性共价键、非极性共价键(各一分,只答共价键得一分)
(3)2H2 -4e- + 4OH- = 4H2O? O2 +4e- + 2H2O =4OH-(各2分)
(4)2NO2 +2OH- = NO3- +NO2- + H2O(2分)
本题解析:根据元素的结构及有关性质可知,A,B,C,D分别是H、O、Na、S。(1)名称分别是氢、氧、钠、硫。(2))写出C、D两元素形成的常见化合物是硫化钠,其电子式要体现出阴阳离子形式;钠和S都是活泼的金属和非金属,形成的化学键是离子键,电子式为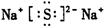 。A、B两元素形成的18电子微粒是过氧化氢,其中所含化学键类型极性共价键、非极性共价键。符合条件的两种物质分别是硫酸氢钠和亚硫酸氢钠,方程式为HSO3-+H+=SO2↑+H2O。(3)原电池中负极失去电子,发生氧化反应。正极得到电子,发生还原反应,所以氢气在负极通入,氧气在正极通入。又因为溶液显碱性,所以电极反应式为负极:
。A、B两元素形成的18电子微粒是过氧化氢,其中所含化学键类型极性共价键、非极性共价键。符合条件的两种物质分别是硫酸氢钠和亚硫酸氢钠,方程式为HSO3-+H+=SO2↑+H2O。(3)原电池中负极失去电子,发生氧化反应。正极得到电子,发生还原反应,所以氢气在负极通入,氧气在正极通入。又因为溶液显碱性,所以电极反应式为负极: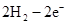

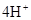 ,正极:
,正极: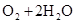
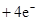

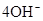 。(4)由A、B、C 三元素构成的化合物X是氢氧化钠,离子方程式为:2NO2 +2OH- = NO3- +NO2- + H2O。
。(4)由A、B、C 三元素构成的化合物X是氢氧化钠,离子方程式为:2NO2 +2OH- = NO3- +NO2- + H2O。
本题难度:一般
4、填空题 (10分)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T的单质既可与盐酸反应,又可与NaOH溶液反应,请回答下列问题:
(1)T的原子结构示意图为_______________。
(2)元素的非金属性为(原子的得电子能力):Q______ R (填“强于”或“弱于”)
3)、T的硫酸盐溶液与过量NaOH溶液反应的离子方程式为?。
4)请写出R与氢形成的氢化物的电子式?
5)、Q、R、T、W的原子半径由大到小的顺序为?
参考答案:(1)、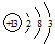 ?(2)、弱于?(3)、Al3++4OH- = AlO2-+2H2O
?(2)、弱于?(3)、Al3++4OH- = AlO2-+2H2O
(4)、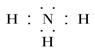 ?(5)、T>W>Q>R
?(5)、T>W>Q>R
本题解析:考查元素周期表的结构和元素周期律的应用。T的单质既可与盐酸反应,又可与NaOH溶液反应,所以T是铝,则根据元素在周期表中的位置可判断,Q是碳,R是氮,W是硫。
(1)铝位于第三周期第ⅢA,结构示意图为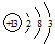 。
。
(2)同周期自左向右非金属性逐渐增强,所以碳的非金属性弱于氮的。
(3)氢氧化铝是两性氢氧化物,能溶于氢氧化钠溶液中,反应式为Al3++4OH- = AlO2-+2H2O。
(4)氮和氢都是非金属,形成的化学键是极性键,所以氨气的电子式为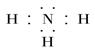 。
。
(5)同主族自上而下原子半径逐渐增大,同周期自左向右原子半径逐渐减小,所以原子半径大小顺序为T>W>Q>R。
本题难度:一般
5、填空题 甲、乙、丙、丁、戊、己为原子序数依次增大的短周期主族元素。甲、丙处于同一主族,丙、丁、戊处于同一周期,乙元素最高化合价与最低价的代数和为0;丙、丁、戊的最高价氧化物的水化物之间都能发生反应。用化学用语回答下列问题:
(1)甲的阴离子的结构示意图为?;用电子式表示乙与戊形成化合物的过程?。
(2)丙、丁、戊的离子半径由大到小的顺序为?;乙、戊、己的氢化物的还原性最弱的是?。
(3)写出由甲乙两元素形成的化合物中,既含有极性键又含有非极性键,且相对分子质量最小的物质的结构式?;该物质与空气在酸性条件下可构成燃料电池,该电池放电时,负极的反应式为?。
(4)丙、丁的最高价氧化物的水化物之间发生反应的离子方程式为??。由甲、丙、戊、己中部分元素形成的两种化合物的水溶液之间可以发生反应,该化学方程式为:?。
(5)按下图电解丙和己形成化合物的饱和溶液,该装置可用于家庭用水的消毒。写出该电解池中发生反应的总反应方程式:?。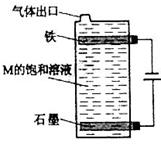
参考答案:(1)?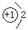 ?(1分)?
?(1分)?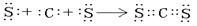 (2分)
(2分)
(2)S2->Na+>Al3+?(2分)? HCl(2分)
(3)H-C≡C-H?(1分)? C2H2 + 4H2O ? 10e-= 2CO2+10H+(2分)
(4)Al(OH)3+OH- =AlO2- +2H2O?(2分);? NaHS+HCl= NaCl+H2S?或 Na2S + H 2S =2 NaHS(2分)
(5)NaCl+H2O NaClO+H2↑?(2分)
NaClO+H2↑?(2分)
本题解析:根据丙、丁、戊处于同一周期,且丙、丁、戊的最高价氧化物的水化物之间都能发生反应,可知丁为Al,该三种元素处于第三周期,氢氧化铝能够与强碱和强酸反应,结合题意,原子序数依次增大的短周期主族元素,推出丙为Na,戊为S,己为Cl;根据乙元素最高化合价与最低价的代数和为0,乙为C元素,甲、丙处于同一主族,甲为H元素。(1)氢的阴离子最外层有2个电子,碳和硫之间以共价键形成CS2;(2)根据电子层数越多半径越大,电子层排布相同的离子,离子半径大小与核电荷数大小成反比,即S2->Na+>Al3+ ,氢化物的还原性与非金属性成反比例,非金属性越强,其氢化物的还原性越弱,其还原性顺序:H2S>CH4>HCl;(3)甲、乙两元素形成的化合物属于烃类,含有极性键又含有非极性键,且相对分子质量最小的物质,含2个碳,含H个数最少,综合判断为乙炔,结构简式为:H-C≡C-H ,乙炔燃料电池,负极是乙炔失去电子发生氧化反应,酸性条件下电极反应式为: C2H2 + 4H2O ? 10e-= 2CO2+10H+;(4)氢氧化钠与氢氧化铝反应离子方程式为Al(OH)3+OH- =AlO2- +2H2O ,H、Na、S、Cl形成的化合物,应该是硫化物(H2S、NaHS或Na2S)和氯化物(HCl和NaCl),其中能发生反应的是NaHS+HCl= NaCl+H2S或Na2S + H 2S =2 NaHS;(5)电解饱和氯化钠溶液,阳极在装置的下部,阳极反应生成的氯气往上溢出的过程中与阴极附近的氢氧化钠反应生成次氯酸钠,起到消毒作用,总电解反应为NaCl+H2O NaClO+H2↑。
NaClO+H2↑。
本题难度:一般