微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (16分)几位同学设计实验观察铜与浓硫酸的反应,检验生成的气体的性质。甲设计了如图所示的装置,在大试管里加入2mL浓硫酸,用带导管和一个小孔的胶管塞紧,从孔中插入一根铜丝,加热,把产生的气体依次通入品红溶液和石蕊溶液中。
请回答下列问题:

(1)写出铜与浓硫酸反应的化学方程式:?。
(2)试管b中的现象是??,
通过试管a、b的现象得出的结论是??。
(3)乙同学认为甲同学的设计不能全面体现SO2的性质,他打算增加试管进行其它实验。以下为增加的试管中盛放的试剂:A. 澄清石灰水? B. KMnO4(aq) C. 氢硫酸
请你帮助乙同学作出选择,在横线上先写出字母,再用文字简单说明实验的目的。
?
?
(4)丙同学评价甲同学的实验装置既有优点也有不足,优点是?
?,不足之处改进的具体措施是?。
(5)若把上述装置中大试管的浓硫酸换成稀硝酸,试管a和b作如下改变(其中a装满水,b空置),则在大试管中发生的反应的离子方程式为?,
试管a的作用是?。
参考答案:(1)Cu + 2H2SO4(浓)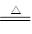 CuSO4 + SO2↑+ 2H2O (2分)
CuSO4 + SO2↑+ 2H2O (2分)
(2)紫色溶液变红色(1分),SO2是一种酸性气体,具有漂白性(能漂白品红)(2分)
(3)B,验证SO2的还原性;C,验证SO2的氧化性。(各1分)
(4)使用可抽动的铜丝能随时控制反应的开始和结束,节约药品用量,减少污染气体的产生(2分);?把尾气通入NaOH溶液中(1分)。
(5)3Cu2+ + 8H+ + 2NO3- = 3Cu2+ + 2NO↑+ 4H2O (2分);
除去NO2,排水法收集纯净的NO(2分)。
本题解析:(1)浓硫酸具有强氧化性,在加热的条件下能氧化铜生成硫酸铜。
(2)浓硫酸的还原产物是SO2,SO2溶于水显酸性,所以紫色溶液变红色。SO2能使品红溶液褪色,具有漂白性。
(3)SO2中S的化合价是+4价,处于中间价态,既有氧化性,又有还原性。因此可以通过酸性高锰酸钾溶液来验证其还原性。通过硫化氢来验证其氧化性。
(4)根据装置的特点可判断,通过使用可抽动的铜丝能随时控制反应的开始和结束,节约药品用量,减少污染气体的产生。但由于SO2属于大气污染为,反应结束后需要进行尾气处理,可将尾气通入氢氧化钠溶液中。
(5)硝酸具有强氧化性,也能把铜氧化生成硝酸铜,而硝酸被还原生成NO2或NO气体。NO不溶于水,NO2溶于水生成NO,所以可利用排水法收集纯净的NO。
本题难度:一般
2、选择题 为研究CO2和SO2的有关性质,某学生做如下实验:如图,烧瓶中分别收集的是两种气体,烧瓶内导管口系着瘪气球,向瓶中滴加品红试液,反应一段时间后,对实验现象的描述正确的是( )

A.甲烧瓶中试液变无色,气球均胀大,且甲大于乙
B.两试液均变无色,气球均胀大,且甲小于乙
C.分别取出瓶中溶液,向其中滴加BaCl2溶液,均能产生白色沉淀
D.分别取出瓶中溶液,向其中滴加BaCl2溶液,甲中的溶液产生白色沉淀,乙不能
参考答案:A
本题解析:本题考查了两种气体的物理性质和化学性质。物理性质方面,因SO2溶解度大于CO2,烧瓶甲内气体压强明显减小,气球鼓胀的程度甲大于乙;化学性质方面,SO2有漂白性,甲烧瓶中因充有SO2,品红试液褪色,而乙烧瓶中无此现象;滴加BaCl2溶液中,均不能产生白色沉淀。答案为A。
本题难度:一般
3、选择题 下列实验用来证明SO2的存在,其中正确的是(?)
A.能使品红褪色。
B.能使湿润的蓝色石蕊试纸变红。
C.通入足量的NaOH溶液中,再滴入BaCl2溶液有白色沉淀生成,该沉淀溶于稀盐酸。
D.通入稀溴水中能使溴水褪色,得澄清溶液,再滴加Ba(NO3)2溶液有白色沉淀,该沉淀不溶于硝酸。
参考答案:D
本题解析:具有漂泊性的物质不止二氧化硫一种,A不能证明。酸性气体都可以使湿润的蓝色石蕊试纸变红,B不能证明。选项C中也可以是CO2,所以也不能证明。通入稀溴水中能使溴水褪色,得澄清溶液,说明该气体具有还原性。再滴加Ba(NO3)2溶液有白色沉淀,该沉淀不溶于硝酸,则说明沉淀是硫酸钡,所以气体是二氧化硫,因此正确的答案是D。
本题难度:一般
4、选择题 下列溶液中能用来区别SO2和CO2气体的是( )
①澄清的石灰水 ②氯水 ③酸性高锰酸钾溶液 ④氯化钡溶液 ⑤品红溶液
A.①④⑤
B.②③⑤
C.①②③
D.②③④
参考答案:B
本题解析:SO2和CO2都是酸性氧化物,都能使澄清的石灰水变混浊,与氯化钡都不反应。但SO2还有还原性和漂白性,所以答案是B。
本题难度:一般
5、选择题 在自然界中,既有以化合态存在,又有以游离态存在的元素是
[? ]
A.硫
B.硅
C.钠
D.铝
参考答案:A
本题解析:
本题难度:简单