?
参考答案:(10分,每行2分
选用的仪器(填字母)
加入的试剂
作用
C
浓H2SO4和木炭
反应器(或发生气体)
B
无水CuSO4
检出H2O
A
品红溶液
检出SO2
A
酸性KMnO4溶液
吸收余下的SO2
A
澄清石灰水
检出CO2
本题解析:浓硫酸和碳的反应需要加热,因此选择C装置,作为发生装置;检验CO2用澄清的石灰水,SO2用品红溶液检验,水蒸气用无水硫酸铜检验。但由于SO2也能使澄清的石灰水反应,且通过溶液时会带出水蒸气,所以首先检验的是水蒸气、其次是SO2,最后是CO2,且在检验CO2之前还需要除去SO2。SO2具有还原性,可用酸性高锰酸钾溶液氧化而除去SO2。
本题难度:一般
2、选择题 下列反应中,硫酸不作氧化剂的是( )?
A.2HBr+H2SO4(浓)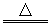 Br2+SO2↑+2H2O? Br2+SO2↑+2H2O?
B.Ca3(PO4)2+2H2SO4(浓) 2CaSO4+Ca(H2PO4)2? 2CaSO4+Ca(H2PO4)2?
C.2Al+3H2SO4====Al2(SO4)3+3H2↑?
D.2KMnO4+5H2S+3H2SO4====K2SO4+2MnSO4+5S↓+8H2O?
参考答案:BD
本题解析:只要H2SO4中某种元素的价态降低(其实只能是H、S元素的价态降低),H2SO4就是氧化剂。A中S元素由+6价变到了+4价,C项中H元素由+1价变到了0价,在这两个反应中,H2SO4都是氧化剂。A、C项不可选。B项反应不是氧化还原反应。B项可选。D项反应中H元素的价态没有改变,S元素的变化为:
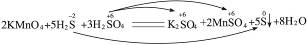
H2SO4没有参加氧化还原反应,不是氧化剂。
本题难度:简单
3、选择题 经检验,某酸雨的成分除含有少量H+和极少量OH-外,还有Na+、Cl-、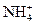 、 、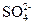 等离子,已知:c(Na+)=7×10-6 mol· L-1,c(Cl-)=3.5×10-5 mol· L-1,c( 等离子,已知:c(Na+)=7×10-6 mol· L-1,c(Cl-)=3.5×10-5 mol· L-1,c(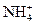 )=2.3×10-5 mol· L-1,c( )=2.3×10-5 mol· L-1,c(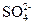 ) =2.5×10-6 mol·L-1,则该酸雨的pH为() ) =2.5×10-6 mol·L-1,则该酸雨的pH为()
A.3
B.4
C.5
D.6
参考答案:C
本题解析:根据溶液呈电中性列出方程式(忽略OH-提供的电荷):
c(Na+)+c(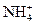 )+c(H+)=c(Cl-)+2c( )+c(H+)=c(Cl-)+2c(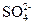 ) )
c(H+)=1.0×10-5 mol·L-1,pH=5。
本题难度:简单
4、选择题 有镁、铝、锡、锌四种金属组成的混合物ag,与适量稀硫酸恰好完全反应,将溶液蒸干得到不含结晶水的硫酸盐的质量为bg,则此过程中产生H2的物质的量是(?)
A.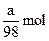
B.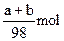
C.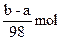
D.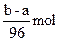
参考答案:D
本题解析:因金属与硫酸反应时存在“H2SO4~H2”,题中(b-a)g为 的质量,物质的量为 的质量,物质的量为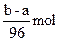 ,则硫酸的物质的量也为 ,则硫酸的物质的量也为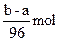 ,根据关系式“H2SO4~H2”得H2的物质的量是 ,根据关系式“H2SO4~H2”得H2的物质的量是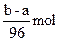 。 。
本题难度:简单
5、填空题 工业制CuSO4时,不是直接用铜跟浓硫酸在加热条件下反应,而是将铜丝浸入稀硫酸中,再不断由容器下部吹入细小的空气泡。这样做的好处是?。
参考答案:①减少了硫酸的用量,提高了硫酸的利用率。②不会产生对大气有污染的SO2。
本题解析:铜与浓硫酸的反应为:Cu+2H2SO4(浓)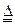 CuSO4+SO2↑+2H2O。分析反应方程式可知:由于浓H2SO4有1/2表现氧化性,1/2表现酸性,导致浓H2SO4的利用率只有50%。又由于生成的二氧化硫是有毒气体,也是引起酸雨的主要成分,所以工业上一般不采用此法。本题所给方法的反应方程式为:2Cu+2H2SO4+O2 CuSO4+SO2↑+2H2O。分析反应方程式可知:由于浓H2SO4有1/2表现氧化性,1/2表现酸性,导致浓H2SO4的利用率只有50%。又由于生成的二氧化硫是有毒气体,也是引起酸雨的主要成分,所以工业上一般不采用此法。本题所给方法的反应方程式为:2Cu+2H2SO4+O2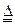 2CuSO4+2H2O。可知:硫酸仅表现酸性。对比以上两种方法,不难看出,这样做的好处主要有两条:①减少了硫酸的用量,提高了硫酸的利用率②不会产生对大气有污染的二氧化硫。 2CuSO4+2H2O。可知:硫酸仅表现酸性。对比以上两种方法,不难看出,这样做的好处主要有两条:①减少了硫酸的用量,提高了硫酸的利用率②不会产生对大气有污染的二氧化硫。
本题难度:简单
|